Биосинтез белка — понятие, последовательность процессов и основные этапы
Содержание:
- Транскрипция
- Что такое фотосинтез
- Внешние ссылки [ править ]
- Ссылки [ править ]
- Молекулярный аппарат трансляции и его консервативность
- Факторы, влияющие на скорость и объем синтеза белка из внешних аминокислот
- Световая фаза фотосинтеза
- Биосинтез белка кратко и понятно
- Сворачивание белков [ править ]
- Транскрипция и трансляция
- Реакция матричного синтеза
- Violation of the metabolism of protein tissues
Транскрипция
На первом этапе транскрипции с цепочки ДНК снимается абсолютно точная копия, в результате которой получается идентичная с исходной цепочка РНК. Для такой информационной копии нужен катализатор, в роли которого выступают ферменты, и источник питания, в случае синтеза белка — это АТФ. Процесс синтеза происходит с высокой скоростью — в пределах одного организма за минуту осуществляется до 60 000 связей на уровне пептидов.
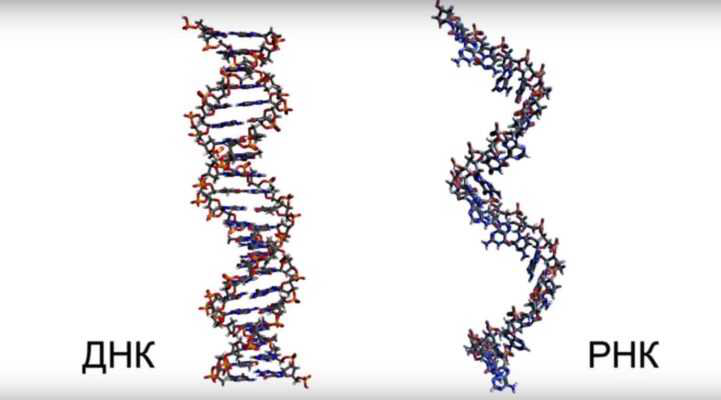
Рис 3. Сравнение ДНК и РНК.
Двойная цепочка ДНК расположена в ядре клетки в виде спирали. В начале транскрипции она разматывается и на одной из частей начинается синтез иРНК, так называемая информационная. Это одинарная цепь, точно повторяющая структуру ДНК. Поэтому реакции биосинтеза белка называют матричными. Вместо тимина, находящегося в нематричной цепочке ДНК, в иРНК используется урацил. В качестве катализатора «работает» РНК-полимераза.
Сложность возникает в том, что генов в молекуле ДНК очень много, а копировать нужно только один из них, причем, строго определенный. То есть, начинать снятие информации РНК должна не только в заданный момент, но и с заданного места. Для исключения ошибок в начале каждого фрагмента ДНК расположен специальный маркер, комбинация нуклеотидов под названием «промотор». Копирование с такого маркера начинается и на таком же, но с противоположной стороны, заканчивается. Конечный маркер получил название «терминатор».
Что такое фотосинтез
Фотосинтез — процесс, при котором в клетках, содержащих хлорофилл, под действием энергии света образуются органические вещества из неорганических. При фотосинтезе растение поглощает углекислый газ и воду, синтезирует органические вещества и выделяет кислород, как побочный продукт фотосинтеза.
Процессы фотосинтеза идут в тканях, содержащих хлоропласты, — преимущественно, в листе, на который приходится большая часть процессов фотосинтеза. Такая ткань называется хлоренхима, или мезофилл.
Строение хлоропластов
Чтобы понять, что происходит в растении при фотосинтезе, изучим подробнее хлоропласты. Хлоропласты — это особые пластиды растительных клеток, в которых происходит фотосинтез. Основные элементы структурной организации хлоропластов высших растений представлены на рис.1.

Рис.1. Строение хлоропласта высших растений
Хлоропласт — это двумембранный органоид. Внешняя мембрана проницаема для большинства органических и неорганических соединений. Она содержит специальные транспортные белки, благодаря которым нужные для работы хлоропласта пептиды и другие вещества попадают в него из цитоплазмы. Внутренняя мембрана обладает избирательной проницаемостью и способна контролировать, какие именно вещества попадут во внутреннее пространство хлоропласта.

Для хлоропластов характерна сложная система внутренних мембран, позволяющая пространственно организовать фотосинтетический аппарат, упорядочить и разделить реакции фотосинтеза, несовместимые между собой, и их продукты. Мембраны образуют тилакоиды, которые, в свою очередь, собираются в «стопки» — граны. Пространство внутри тилакоидов называется внутритилакоидным пространством, или люменом.
Внутреннее пространство хлоропласта между гранами заполняет строма — гидрофильный слабоструктурированный матрикс. В строме содержатся необходимые для реакций синтеза сахаров ферменты, а также рибосомы, кольцевая молекула ДНК, крахмальные зёрна.
Внешние ссылки [ править ]
- Полезное видео, демонстрирующее процесс преобразования ДНК в белок посредством транскрипции и трансляции.
- Видеовизуализация процесса сворачивания белка от нефункциональной первичной структуры к зрелой, свернутой трехмерной структуре белка со ссылкой на роль мутаций и неправильного сворачивания белка при заболевании
- Более продвинутое видео с подробным описанием различных типов посттрансляционных модификаций и их химической структуры.
| vтеПервичная структура белка и посттрансляционные модификации | |||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| Общий |
|
||||||||||||||||||||||||
| N конечная |
|
||||||||||||||||||||||||
| Конечная точка C |
|
||||||||||||||||||||||||
| Отдельные конкретные AA |
|
||||||||||||||||||||||||
| Сшивки между двумя AA |
|
||||||||||||||||||||||||
| Три последовательных АК (образование хромофора) |
|
||||||||||||||||||||||||
| Сшивки между четырьмя AA |
|
| vтеЭкспрессия гена | |||||||
|---|---|---|---|---|---|---|---|
| Введение в генетику |
|
||||||
| Транскрипция |
|
||||||
| Перевод |
|
||||||
| Регулирование |
|
||||||
| Влиятельные люди |
|
| vтеБелки | |||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|
| Процессы |
|
||||||||||
| Структуры |
|
||||||||||
| Типы |
|
||||||||||
|
Ссылки [ править ]
- ^ Б с д е е г ч я J Альберс, Брюс (2015). Молекулярная биология клетки (Шестое изд.). Абингдон, Великобритания: Garland Science, Taylor and Francis Group. ISBN 978-0815344643.
- ^ О’Коннор, Клэр (2010). Основы клеточной биологии . NPG Образование: Кембридж, Массачусетс . Дата обращения 3 марта 2020 .
- ^ а б Ван, Ю-Цзе; Петерсон, Сюзанна Э; Лоринг, Жанна Ф (2013). «Посттрансляционные модификации белков и регуляция плюрипотентности в стволовых клетках человека» . Клеточные исследования . 24 (2): 143–160. DOI10.1038 / cr.2013.151 . PMC 3915910 . PMID 24217768 .
- ^ Шепер, Герт C .; van der Knaap, Marjo S .; Гордый, Кристофер Г. (2007). «Перевод имеет значение: дефекты синтеза белка при наследственных заболеваниях». Природа Обзоры Генетики . 8 (9): 711–723. DOI10.1038 / nrg2142 . PMID 17680008 . S2CID 12153982 .
- ^ Берг, Джереми М; Тимочко, Джон Л; Гатто-младший, Грегори Дж. Страйер, Люберт (2015). Биохимия (Восьмое изд.). США: WH Freeman and Company. ISBN 9781464126109.
- ^ a b c d e f Тул, Гленн; Тул, Сьюзан (2015). AQA биология Уровень A. Студенческая книга (Второе изд.). Грейт-Кларендон-стрит, Оксфорд, OX2 6DP, Великобритания: Oxford University Press. ISBN 9780198351771.
- ^ Берк, Арнольд; Лодиш, Харви; Дарнелл, Джеймс Э (2000). Молекулярная клеточная биология (4-е изд.). Нью-Йорк: WH Freeman. ISBN 9780716737063.
- ^ a b «Обработка пре-мРНК эукариот» . Ханская академия . Дата обращения 9 марта 2020 .
- ↑ Jo, Bong-Seok; Чой, Сун Шим (2015). «Интроны: функциональные преимущества интронов в геномах» . Геномика и информатика . 13 (4): 112–8. DOI10,5808 / GI.2015.13.4.112 . PMC 4742320 . PMID 26865841 .
- ^ «Этапы перевода (статья)» . Ханская академия . Дата обращения 10 марта 2020 .
- ^ «Ядро и рибосомы (статья)» . Ханская академия . Дата обращения 10 марта 2020 .
- ^ а б Купер, GM (2000). Клетка: молекулярный подход (2-е изд.). Сандерленд (Массачусетс): Sinauer Associates. ISBN 9780878931064.
- ^ «Структура белка: первичный, вторичный, третичный и четвертичный (статья)» . Ханская академия . Дата обращения 11 марта 2020 .
- ^ Дуань, Гуанъю; Вальтер, Дирк; Радивояц, Предраг (2015). «Роль посттрансляционных модификаций в контексте сетей взаимодействия белков» . PLOS Вычислительная биология . 11 (2): e1004049. Bibcode2015PLSCB..11E4049D . DOI10.1371 / journal.pcbi.1004049 . PMC 4333291 . PMID 25692714 .
- ^ a b Шуберт, Марио; Walczak, Michal J .; Эби, Маркус; Более широкий, Герхард (2015). «Посттрансляционные модификации интактных белков, обнаруженные с помощью ЯМР-спектроскопии: применение к гликозилированию». Angewandte Chemie International Edition . 54 (24): 7096–7100. DOI10.1002 / anie.201502093 . PMID 25924827 .
- ^ Ciechanover, Аарон; В целом, Кристофер М. (2005). «Протеолиз: от лизосомы к убиквитину и протеасомам». Обзоры природы Молекулярная клеточная биология . 6 (1): 79–87. DOI10.1038 / nrm1552 . PMID 15688069 . S2CID 8953615 .
- ^ Бреннер, Сидней; Миллер, Джеффри Х. (2001). Энциклопедия генетики . Elsevier Science Inc. стр. 2800. ISBN 978-0-12-227080-2.
- ^ Мурн, Джерней; Ши, Ян (2017). «Извилистый путь исследований метилирования белков: вехи и новые рубежи». Обзоры природы Молекулярная клеточная биология . 18 (8): 517–527. DOI10.1038 / nrm.2017.35 . PMID 28512349 . S2CID 3917753 .
- ^ Drazic, Адриан; Myklebust, Line M .; Ри, Расмус; Арнесен, Томас (2016). «Мир ацетилирования белков» . Biochimica et Biophysica Acta (BBA) — Белки и протеомика . 1864 (10): 1372–1401. DOI10.1016 / j.bbapap.2016.06.007 . PMID 27296530 .
- ^ Баннистер, Эндрю J; Кузаридес, Тони (2011). «Регуляция хроматина модификациями гистонов» . Клеточные исследования . 21 (3): 381–395. DOI10.1038 / cr.2011.22 . PMC 3193420 . PMID 21321607 .
- ^ а б Хабара, алави; Стейнберг, Мартин Х (2016). «Мини-обзор: Генетические основы гетерогенности и серьезности серповидно-клеточной анемии» . Экспериментальная биология и медицина . 241 (7): 689–696. DOI10.1177 / 1535370216636726 . PMC 4950383 . PMID 26936084 .
- ^ Мангла, Анкит; Эхсан, Моавия; Марувада, Смита (2020). «Серповидно-клеточная анемия» . StatPearls . StatPearls Publishing. PMID 29489205 . Дата обращения 12 марта 2020 .
- ^ Ilesanmi, Oluwatoyin Olatundun (2010). «Патологические основы симптомов и кризисов при серповидно-клеточном расстройстве: значение для консультирования и психотерапии» . Гематологические отчеты . 2 (1): 2. doi10.4081 / ч . 2010. e2 . PMC 3222266 . PMID 22184515 .
Молекулярный аппарат трансляции и его консервативность
Каждый живой организм на Земле может быть отнесен к одному из трех доменов жизни: это максимально удаленные друг от друга в эволюционном смысле группы — эукариоты (здесь ищите самые известные царства: животных, растений и грибов), бактерии и археи . Эта удаленность означает, что они давно разошлись (то есть их последний общий предок жил давно ), и у представителей групп накопилось множество отличий. Но есть и признаки, по которым представители различных доменов похожи друг на друга. Речь идет об основополагающих признаках: например, способности удваивать ДНК, синтезировать на ее основе РНК и в конце концов получать закодированный в ней белок. Трансляция относится к самым консервативным биологическим процессам.
При ближайшем рассмотрении оказывается, что устройство белоксинтезирующего аппарата довольно схоже у представителей разных доменов. К примеру, основные факторы инициации и элонгации у бактерий имеют гомологов у архей, а рибосомы архей по многим аспектам строения очень напоминают рибосомы эукариот (что даже позволило создать из рибосом дрожжей гибридные рибосомы, в которых одна из субъединица очень напоминала рибосомную субъединицу архей ). В пределах этих трех доменов есть отличия, но мы видим, что трансляционная машинерия в целом очень консервативна, и таких отличий не так много. Это является несомненным свидетельством общности (монофилетичности) происхождения жизни.
Факторы, влияющие на скорость и объем синтеза белка из внешних аминокислот
Рассматривая белковый обмен, как комплексный процесс, нужно учесть все факторы, которые влияют на синтез новых белковых структур из стандартных аминокислот. Так как при нарушении любого из них, все полученные путем сложной ферментации и денатурации аминокислоты просто уйдут в качестве энергии.
- Тестостерон. Он отвечает за потребность синтеза тканей, отвечающих за качество мышечной массы.
- Холестерин. Отвечает за синтез из белковых структур коллагена, косвенно влияет на уровень половых гормонов.
- Протеаза. От количества этого фермента зависит, как долго будет перевариваться белок и денатурировать. Если имеется недостаток протеазы, белок может выйти из кишечника так до конца и не переварившись.
- Уровень базального метаболизма. От этого зависит базовая потребность и расход внутренних запасов белка в течение дня. Для людей с большим уровнем базального метаболизма нужно больше белка в день для поддержания всех функций.
- Скорость метаболических процессов. От этого зависит базовая потребность и расход внутренних запасов белка в течение дня. Для людей с большим уровнем базального метаболизма нужно больше белка в день для поддержания всех функций
- Дефицит/избыток энергии. Если имеется избыток калорийности, то белок будет заполнять и создавать новые структуры. В случае дефицита – он будет просто закрывать дыры. А в случае экстремального дефицита калорийности, белок просто будет пережжен до уровня простейшей энергии.
Световая фаза фотосинтеза
Чтобы лучше понять, что происходит во время фотосинтеза, разберём фазы фотосинтеза. Световая фаза фотосинтеза включает в себя фотохимические и фотофизические процессы, и может быть поделена на три этапа:
- Фаза поглощения — энергия света улавливается при помощи светособирающих комплексов, переходит в энергию электронного возбуждения пигментов, передаётся в реакционный центр фотосистем I и II.
- Фаза реакционных центров — энергия электронного возбуждения пигментов светособирающих комплексов используется для активации реакционных центров фотосистем. В реакционном центре электрон от возбуждённого хлорофилла передаётся другим компонентам электрон-транспортной цепи, пигмент после отдачи электрона переходит в окисленное состояние и становится способным, в свою очередь, отнимать электроны у других веществ. Именно в этом процессе происходит преобразование физической формы энергии в химическую.
- Фаза электрон-транспортной цепи — электроны переносятся по цепи переносчиков, образуются АТФ, НАДФН, O2. Необходимо, чтобы каждый переносчик электрон-транспортной цепи поочерёдно восстанавливался и окислялся, обеспечивая таким образом перенос энергии электронов. Любой этап переноса электрона сопровождается высвобождением или поглощением энергии. Часть энергии теряется. На некоторых участках электрон-транспортной цепи перенос электрона сопряжён с переносом протона.
Для того чтобы понять, что происходит во время фазы фотосинтеза, рассмотрим эти процессы подробнее. Кванты света улавливаются светособирающими комплексами фотосистемы I — молекула хлорофилла в составе светособирающего комплекса переходит в возбуждённое состояние, и энергия передаётся в реакционный центр фотосистемы I. Происходит возбуждение молекул хлорофилла фотосистемы I, отщепляется электрон. Пройдя по цепочке внутренних компонентов фотосистемы I и внешних переносчиков, электрон в конце концов попадает к НАДФ+ — образуется восстановитель НАДФН. Получается, что хлорофилл фотосистемы I отдал электрон и приобрёл положительный заряд, и для дальнейшего функционирования необходимо восстановить нейтральность молекулы, получить электрон, чтобы закрыть «дырку». Этот электрон приходит от фотосистемы II.
На светособирающие комплексы фотосистемы II попадают кванты света — происходит возбуждение молекулы хлорофилла фотосистемы II, молекула хлорофилла отдаёт электрон и переходит в окисленное состояние. Нехватку электрона хлорофилл восполняет благодаря фотолизу воды, при этом образуется протоны H+, а также важный побочный продукт фотосинтеза — кислород. По цепи переносчиков электрон от хлорофилла фотосистемы II попадает к хлорофиллу реакционного центра фотосистемы I и восстанавливает его. Теперь этот хлорофилл может снова поглощать энергию кванта света и отдавать электрон в электрон-транспортную цепь.
Протоны, попадающие во внутритилакоидное пространство, используются для синтеза АТФ. С помощью фермента АТФ-синтазы за счёт градиента протонов образуется АТФ из АДФ и фосфата. Под градиентом понимают неравномерное распределение: во внутритилакоидном пространстве H+ больше, в строме — меньше. Поэтому частицы стремятся проникнуть в строму, переходят в неё через АТФ-синтазу, а в процессе пути сквозь белковый комплекс отдают ему часть энергии, которая и используется для синтеза АТФ.
Биосинтез белка кратко и понятно
Процесс синтеза в биологии, как и в любой другой отрасли — это образование сложных структур из менее сложных. При этом строение составных элементов может частично, или даже полностью сохраняться в неизменном виде, а может полностью изменяться. В первом случае синтез напоминает строительство конструкций из кубиков Лего, а во втором — образование сложных сплавов, солей и гидроксидов, свойства которых совершенно другие и ничем не напоминают исходные элементы.
Биосинтез — один из самых сложных видов таких преобразований исходных компонентов. Сюда входят процессы формирования ДНК из отдельных нуклеотидов, строительство белков из аминокислот, фотосинтез. Биосинтез может происходить (и происходит как естественным путем, в организме человека, животных и некоторых растений, так и искусственным — производство белковых питательных веществ.
Сворачивание белков [ править ]
Показывает процесс сворачивания полипептидной цепи от ее исходной первичной структуры до четвертичной структуры.
После завершения синтеза полипептидной цепи полипептидная цепь сворачивается, принимая определенную структуру, которая позволяет белку выполнять свои функции. Основная форма белковой структуры известна как первичная структура , которая представляет собой просто полипептидную цепь, то есть последовательность ковалентно связанных аминокислот. Первичная структура белка кодируется геном. Следовательно, любые изменения в последовательности гена могут изменить первичную структуру белка и все последующие уровни структуры белка, в конечном итоге изменяя общую структуру и функцию.
Первичная структура белка (полипептидная цепь) может затем складываться или скручиваться, образуя вторичную структуру белка. Наиболее распространенные типы вторичной структуры известны как альфа-спираль или бета-лист , это небольшие структуры, образованные водородными связями, образующимися внутри полипептидной цепи. Эта вторичная структура затем сворачивается, образуя третичную структуру белка. Третичная структура — это общая трехмерная структура белков, которая состоит из различных вторичных структур, складывающихся вместе. В третичной структуре ключевые особенности белка, например активный центр, складываются и формируются, позволяя белку функционировать. Наконец, некоторые белки могут принимать сложную четвертичную структуру.. Большинство белков состоят из одной полипептидной цепи, однако некоторые белки состоят из нескольких полипептидных цепей (известных как субъединицы), которые сворачиваются и взаимодействуют с образованием четвертичной структуры. Следовательно, весь белок представляет собой комплекс из нескольких субъединиц, состоящий из нескольких субъединиц полипептидной цепи, например гемоглобина .
Транскрипция и трансляция
Это два наиглавнейших шага биосинтеза.
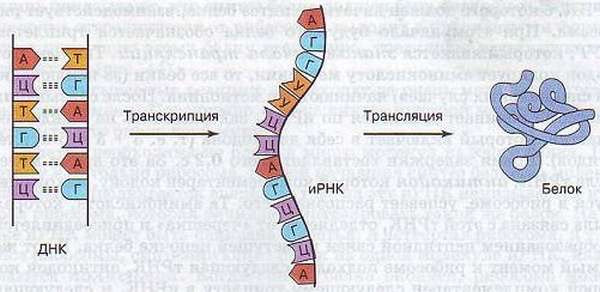
Транскрипция с латинского означает «переписывание» – в качестве матрицы применяется ДНК, поэтому происходит синтезирование трёх видов РНК (матричной/информационной, транспортной, рибосомной рибонуклеиновых кислот). Реакция осуществляется с помощью полимеразы (РНК) и с использованием большого количества аденозинтрифосфата.
Выделают два основных действия:
Трансляция с латинского означает «перевод» – используется иРНК в качестве матрицы, синтезируются полипептидные цепочки.
Трансляция включает в себя три этапа, которые можно было представить в виде таблицы:
Реакция матричного синтеза
В живых системах мы встречаемся с новым типом реакций, наподобие редупликации ДНК, или реакцией синтеза РНК. Такие реакции неизвестны в неживой природе. Их называют реакциями матричного синтеза.
Термином «матрица» в технике обозначают форму, употребляемую для отливки монет, медалей, типографского шрифта: затвердевший металл в точности воспроизводит все детали формы, служившей для отливки. Матричный синтез напоминает отливку на матрице: новые молекулы синтезируются в точном соответствии с планом, заложенным в структуре уже существующих молекул. Матричный принцип лежит в основе важнейших синтетических реакций клетки, таких, как синтез нуклеиновых кислот и белков. В этих реакциях обеспечивается точная, строго специфичная последовательность мономерных звеньев в синтезируемых полимерах. Здесь происходит направленное стягивание мономеров в определенное место клетки — на молекулы, служащие матрицей, где реакция протекает. Если бы такие реакции происходили в результате случайного столкновения молекул, они протекали бы бесконечно медленно. Синтез сложных молекул на основе матричного принципа осуществляется быстро и точно.
Роль матрицы в матричных реакциях играют макромолекулы нуклеиновых кислот ДНК или РНК. Мономерные молекулы, из которых синтезируется полимер, — нуклеотиды или аминокислоты — в соответствии с принципом комплементарности располагаются и фиксируются на матрице в строго определенном, заданном порядке. Затем происходит «сшивание» мономерных звеньев в полимерную цепь, и готовый полимер сбрасывается с матрицы. После этого матрица готова к сборке новой полимерной молекулы. Понятно, что как на данной форме может производиться отливка только какой-то одной монеты, одной буквы, так и на данной матричной молекуле может идти «сборка» только какого-то одного полимера.
Матричный тип реакций — специфическая особенность химизма живых систем. Они являются основой фундаментального свойства всего живого — его способности к воспроизведению себе подобного.
Violation of the metabolism of protein tissues
Very often, considering chronic and clinical metabolic disorders in humans, people do not touch upon the processes of protein metabolic disorders. But it is much easier to get it than metabolic disorder generally. Disruption of protein metabolism is obtained due to the following reasons:
- Violation of the acidic environment of the stomach and intestines. In this case, not all proteins break down into amino acids, which leads to bloating and problems with stool.
- Disfermentation in the stomach. Proteins are not assimilated by the body as a whole. To solve the problem, you need to contact a gastroenterologist; taking enzymes can act as a temporary measure. However, dysfermentation is a serious human problem that can lead to more difficult consequences for treatment.
- Violation of the synthesis of protein tissues. This is due to hormonal imbalances. In this case, the synthesis of protein tissues of internal organs is usually not affected. Muscle synthesis is affected. Usually indicates a lack of testosterone hormone or problems associated with the breakdown of proteins and the transport of certain types of amino acids.
- Violation of hormone secretion. External manifestations are manifested in the form of excessive synthesis of muscle tissue or insufficient. However, it is worth remembering that if this violation was not caused artificially, then such a violation can lead to the formation of tumors and cancerous growths.
- Violation of cholesterol levels. With an excess of cholesterol, proteins bind it, thereby being used for other purposes. In addition, an excess of cholesterol is a violation in meal planning, and can lead to complications such as heart attack and stroke.
Depending on the cause, a violation of protein metabolism can lead to different consequences. However, unlike a violation of fat metabolism, it will not only lead to the fact that you gain extra pounds, but can also completely disable your body. Some diseases associated with impaired protein metabolism — pancreatitis and pancreatic necrosis, can even lead to death. Therefore, you should not neglect high-quality protein foods in your diet.
- About the Developer

About the Developer Nikolay Starkov Editor in chief , sportfito.ru I go in for sports professionally and make up a food menu for proper weight loss. I decided to blog on the Internet to share the rules for losing weight for everyone. Let’s lose weight together!






