Саркоплазма мышечных волокон
Содержание:
Саркоплазма мышечных волокон
Объем внутри мышечного волокна заполнен желеобразным коллоидным раствором – саркоплазмой. В ней протекают активные биохимические процессы расщепления и синтеза разнообразных органических веществ, обеспечивающих энергетическое снабжение сократительного аппарата.
Внутри саркоплазмы мышечного волокна содержатся:
- органеллы специального назначения (миофибриллы);
- органеллы общего назначения,
- включения.
Об органеллах специального назначения (миофибриллах) уже было подробно рассказано, также очень подробно описаны органеллы общего назначения: ядра, митохондрии, саркоплазматический ретикулум, рибосомы, лизосомы, комплекс Гольджи. Теперь подробнее остановимся на включениях. Включения мышечного волокна содержат: белки, экстрактивные вещества, углеводы, жиры и многое другое.
Более подробно строение и функции мышц описаны в моих книгах «Гипертрофия скелетных мышц человека» и «Биомеханика мышц«
Белки саркоплазмы
На долю белков саркоплазмы приходится 25-30% белков мышц.
Во-первых, к белкам саркоплазмы можно отнести все белки, которые необходимы для миофибриллогенеза (синтеза миофибрилл) и для обеспечения структуры мышечного волокна. Так как наши мышечные волокна постоянно разрушаются и синтезируются, следовательно, в саркоплазме должны обязательно присутствовать белки из которых строятся миофибриллы. К таким белкам относятся: миозин (основной белок толстого филамента), актин, тропонин и тропомиозин (основные белки тонкого филамента), титин (соединяет толстый филамент с Z-диском), десмин, виментин, синемин, дистрофин, спектрин (белки, участвующие в привязке миофибрилл друг к другу и к сарколемме мышечного волокна).
Во-вторых, одним из необходимых компонентов саркоплазмы является белок миоглобин. Посредством этого белка осуществляется перенос кислорода внутри мышечного волокна.
В-третьих, в саркоплазме находятся различные ферменты. Напомню, что ферменты — это особые белки, выполняющие функцию катализаторов химических реакций. Среди саркоплазматических белков можно выделить следующие:
- АТФ-азу — фермент, принимающий активное участие в сокращении мышечного волокна, так как он является катализатором реакции гидролиза, при которой происходит выделение энергии.
- Креатинкиназу — фермент, который участвует в креатинфосфатном пути ресинтеза АТФ. При повреждении мышечных волокон концентрация креатинкиназы в крови возрастает.
- Основные ферменты гликолиза: фосфорилазу и фосфофруктокиназу, расщепляющие гликоген или глюкозу до пировиноградной или молочной кислоты.
Помимо белков в саркоплазме содержатся аминокислоты, из которых синтезируются белки. В большом количестве имеется глутаминовая кислота и глутамин.
Экстрактивные вещества
В саркоплазме также содержатся небелковые азотсодержащие вещества. Среди них: АТФ, АДФ и АМФ. К экстрактивным веществам относится креатинфосфат, креатин и креатинин.
Углеводы саркоплазмы
В саркоплазме имеется основной углевод – гликоген. Свободной глюкозы в саркоплазме мало. При мышечном сокращении в саркоплазме накапливаются продукты углеводного обмена – лактат и пируват.
Также в саркоплазме мышечных волокон имеются капельки жира. И, конечно, одним из основным компонентов саркоплазмы является вода.
Сокращение мышечного волокна
При сокращении мышечного волокна в саркоплазму из саркоплазматического ретикулума выделяются ионы кальция. После окончания сокращения мышечного волокна ионы кальция закачиваются обратно в саркоплазматический ретикулум посредством кальциевого насоса.
В саркоплазме мышечных волокон имеются ионы калия (К+). Во время сокращения мышечного волокна ионы калия через калиевые каналы выходят из мышечного волокна в тканевую жидкость, а в саркоплазму мышечного волокна проникают ионы натрия (Na+). После окончания сокращения мышечного волокна посредством натрий-калиевых насосов (Na+— К+) ионы калия закачиваются в саркоплазму мышечного волокна, а ионы натрия – в тканевую жидкость, окружающую мышечные волокна.
Вязкость саркоплазмы
Саркоплазма обладает сравнительно высокой вязкостью, которая еще больше возрастает при возбуждении мышечного волокна. Вследствие этого она оказывает сопротивление укорочению миофибрилл, то есть создает внутреннее трение и в большей или меньшей мере замедляет сокращение или расслабление мышцы.
Аминокислоты
Белки состоят из аминокислотной цепи. Аминокислоты связываются между собой с образованием пептидных цепей, более 10 аминокислот — полипептиды.
Общая формула аминокислот H 2 N – CHR – COOH. Строение отдельных аминокислот кардинально отличается. Согласно им выделяют три основные группы аминокислот:
- алифатические;
- ароматические;
- гетероциклические.
Алифатические кислоты делятся на моноаминомонокарбоновые и моноаминодикарбоновые кислоты. В молекуле трех аминокислот — цистеина, цистина и метионина содержится атом серы.
 Строение аминокислот
Строение аминокислот
Аминокислоты — бесцветные кристаллические вещества. За исключением глицина, все они имеют асимметричный атом углерода и оптически активны. Человеческий белок содержит 20 отдельных аминокислот. Некоторые из них незаменимы (существенны), другие — заменяемы, потому что их можно синтезировать.
Во время катаболизма всех аминокислот образуются шесть веществ, которые участвуют в общем катаболическом процессе. Эти вещества представляют собой пируват, ацетил-КоА, кетоглутарат, сукцинил-КоА, фумарат и оксалоацетат.
Аминокислоты, из которых промежуточные продукты цикла Кребса (α-кетоглутарат, сукцинил-КоА, фумарат) образуются во время катаболизма и впоследствии превращаются в конечный продукт оксалоацетат и могут использоваться для гликогенеза, называются гликогенными аминокислотами.
Некоторые аминокислоты превращаются в ацетоацетат или ацетил-CoA во время катаболизма и могут использоваться для синтеза ацетоновых материалов. Их называют кетогенными. Многие аминокислоты используются в синтезе веществ глюкозы и ацетона, потому что катаболизм производит два продукта, соответствующий метаболит цикла Кребса и ацетоацетат (Tyr, Phe, Trp) или ацетил-КоА (Ile). Такие аминокислоты называют смешанными или гликокетогенными.
Почти все природные аминокислоты (за исключением метионина) реагируют с α-кетоглутаровой кислотой. Эта катализируемая трансаминазой реакция дает глутаминовую кислоту и соответствующую α-кетоновую кислоту. Образовавшаяся глутаминовая кислота подвергается окислительному дезаминированию под действием каталитической глутаматдегидрогеназы.
Группы скелетных мышц
Мышцы тела человека подразделяют в соответствии с их расположением в организме.
Мышцы головы по функциям делят на жевательные и мимические.
Жевательные мышцы одним концом прикреплены к костям черепа, другим – к нижней челюсти. Они необходимы для механического измельчения и перемешивания пищи, то есть для её пережёвывания.
Мимические мышцы одним концом прикреплены к лицевой части черепа, а другим – к внутренней поверхности кожи лица. Круговые мышцы рта и глаз являются исключением среди скелетных мышц, они не прикреплены к костям. Мимические мышцы осуществляют открывание и закрывание глаз, придают лицу определённое выражение, а также служат для произнесения некоторых звуков.
Мышцы шеи обеспечивают движения шеи и головы, а также нижней челюсти.
Мышцы спины осуществляют движения головы, шеи, лопаток. Они могут приподнимать и опускать руки. Также благодаря спинным мышцам поддерживается вертикальное положение тела.
Одна группа мышц груди присоединена к костям плечевого пояса и рук и участвует в их движении. Другая – межреберные мышцы, они поднимают и опускают рёбра при внешнем дыхании.
Мышцы живота формируют передние и боковые стенки живота, вместе их называют брюшным прессом. Их так назвали потому, что при совместном сокращении они надавливают на внутренние органы, располагающиеся в брюшной полости. Мышцы живота необходимы для поворотов туловища в стороны и наклонов. Они участвуют в дыхательных движениях, а также во многих других процессах жизнедеятельности. При этом брюшной пресс выполняет не только двигательную, но и защитную функцию.
К мышцам живота относят также диафрагму, которая герметично разделяет полость тела человека на грудную и брюшную полости. Основная функция диафрагмы – участие в дыхательных движениях.
Мышцы плечевого пояса и руки обслуживают разные и сложные перемещения руки и её отделов.
Мышцы тазового пояса и ноги:
- Тазовые мышцы обеспечивают движение бедра.
- Мышцы бедра участвуют в движении бедра и голени.
- Мышцы голени необходимы для движения стопы.
- Мышцы стопы сгибают и разгибают пальцы ног.
КРАТКАЯ ХАРАКТЕРИСТИКА МЫШЕЧНЫХ ВОЛОКОН СКЕЛЕТНЫХ МЫШЦ
В прошлый раз мы познакомились с тем, из каких основных компонентов состоят наши скелетные мышцы. Теперь мы познакомимся со структурой скелетных мышц и функцией отдельных ее компонентов.
Итак, начнем с самого главного компонента мышцы — мышечных волокон. В мышце мышечные волокна составляют приблизительно 85%. На долю всех остальных компонентов остается 15%.
Длина мышечного волокна
Долгое время считалось, что длина мышечных волокон может быть очень большой, более 30 см. Однако ученый А.Дж. МакКомас в своей книге «Скелетные мышцы» показал, что длина мышечных волокон составляет приблизительно 12 см. Можно, однако возразить: «А как же длинные мышцы? Ведь их длина иногда составляет более 40 см?». А.Дж. МакКомас считает, что длинные мышцы состоят из участков, называемых компартментами. Длина этих участков как раз и составляет 12 см. Портняжная мышца состоит из четырех компартментов, полусухожильная – из трех, двуглавая бедра – из двух.
Более подробно строение и функции мышц описаны в моих книгах «Гипертрофия скелетных мышц человека» и «Биомеханика мышц«
Длина мышечного волокна зависит от типа мышцы. В перистых мышцах (мышечные волокна прикрепляются под углом к линии, соединяющей начало и конец мышцы) мышечные волокна значительно короче, чем в веретенообразных мышцах (мышечные волокна расположены параллельно линии соединяющей начало и конец мышцы). Так в латеральной широкой мышце бедра, одной из головок четырехглавой мышцы (перистой), длина мышечных волокон составляет 7,2 см.
Площадь поперечного сечения мышечного волокна
Диаметр мышечных волокон варьирует от 20 до 80 мкм (1 мкм – это одна миллионная метра). Существует очень важный показатель, характеризующий мышечное волокно – площадь его поперечного сечения. На основе этого показателя многие ученые судят о гипертрофии мышечного волокна – то есть увеличении его объема. Естественно, площадь поперечного сечения мышечного волокна зависит от целого ряда факторов: типа мышцы, типа мышечного волокна, пола, возраста, уровня тренированности. У не тренирующихся молодых мужчин этот показатель в среднем равен 5500 мкм2, а у женщин – 3500 мкм2.
Энергетика мышечного волокна
Основная функция мышечных волокон – преобразование химической энергии в механическую. В мышечных волокнах выделение энергии происходит в результате реакции гидролиза АТФ (соединения с водой). Универсальным источником энергии в живом организме является молекула аденозинтрифосфата (АТФ), которая при соединении с водой (Н2О) отсоединяет одну фосфатную группу и превращается в аденозиндифосфат (АДФ), при этом выделяется энергия.
АТФ+Н2О → АДФ+Н3РО4 + энергия
Запасы АТФ в мышечных волокнах незначительны (5 моль/кг) и их достаточно для выполнения мышечной работы в течение 1-2 с, поэтому для обеспечения более продолжительной мышечной деятельности должно происходить пополнение запасов АТФ. Образование АТФ в мышечных волокнах непосредственно во время физической работы называется ресинтезом АТФ. Реакция ресинтеза АТФ имеет следующий вид:
АДФ + фосфат + энергия → АТФ.
Таким образом, при функционировании мышц в них одновременно протекают два процесса: гидролиз АТФ, дающий необходимую энергию для сокращения и расслабления мышц, и ресинтез АТФ, восполняющий потери этого вещества.
Рекомендуемая литература
- Ванек Ю. Спортивная анатомия.- М.: Академия, 2008.- 304 с.
- Мак-Комас А. Дж. Скелетные мышцы человека. – Киев: Олимпийская литература, 2001.- 407 с. (Текст этой монографии А.Дж. Мак-Комаса ориентирован на подготовленного читателя.)
- Самсонова, А.В. Влияние силовой тренировки на параметры, определяющие объем скелетных мышц человека /А.В. Самсонова, И.Э. Барникова //Культура физическая и здоровье, 2013.- № 4 (46).- С. 35-38
- Самсонова, А.В. Гипертрофия скелетных мышц человека. – СПб: Кинетика, 2018. – 159 с. (В этом учебном пособии состав скелетных мышц описан подробно, текст ориентирован на неподготовленного читателя).
- Ткачук М.Г., Степаник И.А. Анатомия. – М.: Советский спорт, 2010. 392 с. (для неподготовленного читателя)
Моль – единица измерения количества вещества. 1 моль равен количеству вещества, в котором содержится NA частиц. NA – постоянная Авогадро. NA = 6,02214179×1023.
Какие продукты питания относятся к белковой пище
Большинство из нас знает, что мясо, курица, рыба, молоко являются белковой пищей. Но есть и другие виды продуктов, способные дать организму необходимые аминокислоты. Это бобовые, некоторые овощи и фрукты, грибы, зерновые.
Яйца
Отличный источник диетического белка, богаты незаменимыми аминокислотами, витаминами и железом. Используется в детском и взрослом питании. В то же время яйца высококалорийны. Если не хотите набрать лишний вес, ешьте только белок.
Одно среднее яйцо содержит 6 г белка и 78 ккал. Подробнее о том, чем полезны яйца для организма, читайте ЗДЕСЬ.
![]()
Молочные продукты
Помимо органических кислот, которых особенно много в сыре и твороге, молочные изделия богаты кальцием. Этот элемент необходим для женщин и детей. Пробиотики, содержащиеся в кефире, ряженке, сметане, йогурте улучшают микрофлору кишечника и способствуют пищеварению.
Также почитайте статью о других полезных продуктах для микрофлоры кишечника.
Калорийность молочно-белковых продуктов невысока, поэтому смело включайте их в диету.
![]()
Мясо
Самый белковый продукт. В составе присутствуют все 20 аминокислот, восемь из которых организм может получить только из пищи. Протеином богаты говядина, телятина, баранина, свинина. В курице и индейке белка меньше.
Субпродукты содержат мало органических кислот, но много микроэлементов (железа, цинка, меди, селена). Поэтому людям, следящим за здоровьем, нельзя обходить их стороной.
![]()
Рыба
Отличный продукт для белковый диеты. Содержит много аминокислот и фосфора, который участвует в минерализации зубов и костей.
К видам, которые содержат наибольшее количество нутриента относят: тунца (24,5 г), лосося (20,5 г), сельдь (19,4 г), форель (19,2 г).
![]()
Бобовые
Лучший белковый продукт растительного происхождения. Содержит все восемь незаменимых аминокислот. Наиболее богата протеином соя — до 40% в сухих бобах.
Дальше по списку идут горох и фасоль — 100–200 г зерен достаточно для покрытия суточной потребности в нутриенте. Если аминокислот нужно больше, включите в меню изолят сои. Этот продукт содержит рекордное количество пептидов — 33–35%.
![]()
Крупы
В зерновых на долю протеина приходится от 7 до 15% от общей массы, поэтому их можно смело отнести к белковой пище. В большей части круп белок представлен глютеном.
![]()
Орехи и семена
Белково-жировая группа продуктов. Их пищевая ценность зашкаливает. Не лучший выбор для человека, мечтающего похудеть. Относятся к растительным и менее полноценным пептидным соединениям.
![]()
Грибы
Относятся к белковым продуктам. Из-за входящего в состав хитина плохо перевариваются. На степень усвоения грибов влияет кислотность желудочного сока, поэтому их не стоит употреблять людям с заболеваниями ЖКТ.
Содержание протеина в сырых грибах не превышает 4 грамм. В сухой массе может достигать 30%.
![]()
Овощи и зелень
Вы удивитесь, но овощи и зелень также являются белковыми продуктами. Конечно, их ценность значительно ниже, чем мяса. Отчасти по причине неполноценного состава аминокислот, отчасти из-за присутствия веществ, затрудняющих расщепления протеина.
Первое место в рейтинге белково-углеводных продуктов занимают чеснок (6,3 г), брокколи и брюссельская капуста (3,5 г), кукуруза (3,3 г), кабачки (2,7 г). В других овощах и зелени содержится не более 1,5 г белка.
![]()
Фрукты, ягоды и сухофрукты
На последнем месте по количеству белковых соединений стоят фрукты и ягоды. В сухофруктах состав аминокислот чуть богаче, однако не настолько, чтобы считать их основой рациона. Преимущество этой группы продуктов в большом количестве витаминов, макро- и микроэлементов, облегчающих расщепление белка.
Небольшое количество нутриента вы найдете в гранате (1,6 г). Маракуйя и авокадо содержат 2,5 г, а ежевика, малина, абрикосы, бананы, цитрусовые — 1,5 г полипептидов.
![]()
ОПОРНО-ДВИГАТЕЛЬНАЯ СИСТЕМА ЖИВОТНЫХ
18.4.7. Медленные и быстрые мышечные волокна
Выделяют два типа скелетных мышечных волокон, каждый из которых имеет свои физиологические особенности. Это медленные (тонические) и быстрые (фазические волокна). Их строение, локализация и общие свойства указаны в табл. 18.3. В некоторых мышцах могут быть только быстрые или только медленные волокна, в других — волокна обоих типов в определенном соотношении.
Таблица 18.3. Строение, локализация и общие свойства быстрых и медленных мышечных волокон
|
Медленные (тонические) волокна |
Быстрые (фазические) волокна |
|
|
Строение |
Много митохондрий Саркоплазматический ретикулум развит слабо Красные — из-за присутствия миоглобина и цитохромных пигментов Содержание гликогена невелико Тесный контакт волокон с капиллярами для ускорения обмена веществами |
Мало митохондрий Саркоплазматический ретикулум хорошо развит Белые — миоглобина и цитохромных пигментов мало или нет вовсе Обилие гликогеновых гранул |
|
Расположение |
В глубоких слоях мышц конечностей |
Ближе к поверхности |
|
Иннервация |
Тонкие нервные волокна (5 мкм в диаметре). На одном мышечном волокне несколько концевых пластинок (это называется мультитерминальной иннервацией). Скорость проведения импульса 2—8 м · с-1 |
Толстые нервные волокна 10—20 мкм в диаметре. Обычно на одном мышечном волокне одна концевая пластинка (могут быть две). Скорость проведения 8—40 м · с-1 |
|
Возбудимость |
Мембрана не обладает электрической возбудимостью. Каждый импульс приводит к высвобождению лишь небольшого количества ацетилхолина. Таким образом, степень деполяризации мембраны зависит от частоты поступления раздражителей |
Мембрана обладает электрической возбудимостью |
|
Тип ответа |
Медленное градуальное сокращение. Медленное расслабление (приблизительно в 100 раз медленнее, чем у быстрых волокон) |
Быстрое сокращение (в 3 раза быстрее, чем у медленных волокон). Довольно быстрое утомление |
|
Физиологическая активность |
Источник АТФ — аэробное дыхание. Многие волокна при недостатке 02 продолжают работать за счет анаэробного гликолиза; в этом случае образуется молочная кислота и создается кислородная задолженность. По мере окисления дыхательного субстрата мобилизуются запасы углеводов или липидов. Тепло отводится от мышцы по мере его выработки Устанавливается равновесие между потребностями работающей мышцы и мышцы в покое |
Источник АТФ — анаэробные процессы (гликолиз). Быстро возникает кислородная задолженность. В качестве дыхательного субстрата интенсивно используется гликоген. Тепло поглощается волокнами, так как кровеносная система не обеспечивает его быстрого отведения Мышца некоторое время сокращается и тогда, когда кровеносная система не успевает обеспечить дополнительную доставку кислорода |
|
Функция |
Обеспечивают длительное сокращение мышцы; это используется для поддержания позы |
Обеспечивают немедленное быстрое сокращение, когда кровеносная система еще только приспосабливается к новому уровню мышечной активности; поэтому очень важны при локомоции |
Благодаря волокнам этих двух типов организм способен передвигаться и поддерживать позу. Быстрые волокна позволяют мышце сокращаться с высокой скоростью. В большом количестве эти волокна имеются у хищников; они обеспечивают быстроту реакций при ловле добычи. Вместе с тем потенциальная добыча, чтобы не стать жертвой хищников, тоже должна быть способна к быстрому реагированию. В обоих случаях от подвижности животного будут зависеть его шансы на выживание.
Когда животное находится в покое, оно поддерживает определенную позу с помощью тонических мышечных волокон. Им свойственно более медленное и длительное сокращение, но зато энергетические затраты при этом меньше, чем при сокращении быстрых волокон.
У человека все мышцы тела состоят из волокон обоих типов, но обычно один из них доминирует. Это имеет физиологическое значение, поскольку тонические мышцы способны к медленному и длительному сокращению и их соответственно больше в позных мышцах-разгибателях, тогда как в сгибателях, предназначенных для быстрых реакций, преобладают фазические волокна.
Быстрые мышечные волокна иногда называют белыми: в них относительно мало красного пигмента миоглобина, связывающего кислород. В медленных волокнах его намного больше и их называют красными.
ПредыдущаяСледующая
Мышечные сокращения
Сокращение мышцы может наступить при условии, если сила раздражения достигает определенной величины. Наименьшая сила раздражения, вызывающая самое слабое сокращение мышцы, называется пороговым раздражением. Раздражение меньшей силы, чем пороговое (оно не вызывает сокращения мышцы), называется подпороговым, а раздражение большей силы — надпороговым.
Степень сокращения мышц до известного предела зависит от силы раздражения. Дело в том, что мышечные волокна, входящие в состав каждой мышцы, обладают разной степенью возбудимости: одни сокращаются в ответ на меньшую силу раздражения (высокая возбудимость), другие — в ответ на большую (низкая возбудимость). Поэтому увеличение силы раздражения выше пороговой до определенного предела будет сопровождаться повышением степени сокращения.
При изучении сокращений скелетных (поперечнополосатых) мышц принято различать одиночное мышечное сокращение и длительное (суммарное) сокращение, или тетанус.
Одиночное сокращение можно вызвать только искусственно в лаборатории на нервно-мышечном препарате. Оно возникает в ответ на одно кратковременное раздражение (один импульс). На миограмме одиночного мышечного сокращения (рис. 51, А) различают три периода. Мышца начинает сокращаться всегда через некоторое время после раздражения. Первый период — между приложением раздражителя и началом сокращения мышцы — называют периодом скрытого возбуждения, или латентным периодом. Для мышц человека он измеряется тысячными долями секунды. Затем следует второй период — период сокращения, или укорочения мышцы, и за ним третий — период расслабления мышцы.
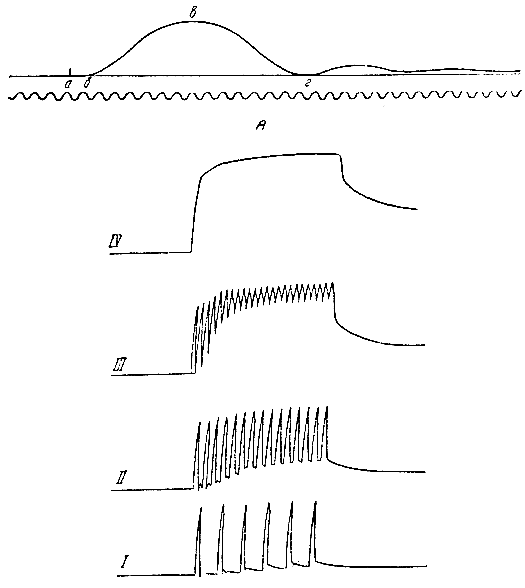 Рис. 51. А — кривая одиночного мышечного сокращения, а — момент раздражения; б — начало сокращения; а, б — латентный период; б, в, г — кривая сокращения мышцы. Б — различные виды тетануса. I — одиночные сокращения; II, III — зубчатый тетанус; IV — гладкий тетанус
Рис. 51. А — кривая одиночного мышечного сокращения, а — момент раздражения; б — начало сокращения; а, б — латентный период; б, в, г — кривая сокращения мышцы. Б — различные виды тетануса. I — одиночные сокращения; II, III — зубчатый тетанус; IV — гладкий тетанус
Возбудимость мышц в течение одиночного сокращения изменяется. Так, в латентном периоде мышца вначале не возбудима (рефрактерная фаза), в периоде сокращения возбудимость мышцы постепенно возрастает и достигает уровня более высокого, чем в состоянии покоя (фаза экзальтации), вслед за этим, в период расслабления, возбудимость мышцы падает. К периоду покоя возбудимость мышцы возвращается к исходному уровню.
В целом организме имеют место не одиночные, а длительные, или тетанические, сокращения скелетных мышц (тетанус). Тетанические сокращения являются результатом того, что в организме раздражения к мышцам из центральной нервной системы по нервам поступают не в виде однократных импульсов, а одно за другим. Форма длительного (тетанического) сокращения зависит от частоты импульсов. Если частота импульсов меньше продолжительности одиночного сокращения (0,1 секунды), то возникает серия одиночных мышечных сокращений (рис. 51, Б, I). Если частота будет больше и следующий импульс будет поступать в момент расслабления мышцы, сокращение приобретет форму зубчатого тетануса (рис. 51, II и III). При дальнейшем возрастании частоты импульсов они будут поступать в мышцу в фазу экзальтации. При этом возникает гладкий тетанус, характеризующийся непрерывными сокращениями (рис. 51, Б, IV). Частота импульсов столь велика, что новое возбуждение в мышце возникает раньше, чем закончилось предыдущее сокращение.
Таким образом, форма мышечного сокращения зависит от частоты импульсов, а величина сокращения — как от силы, так и от частоты раздражений.
Как установил Н. Е. Введенский, существует наилучший, или оптимальный, ритм раздражений, при котором степень сокращения (высота тетануса) будет наибольшей. Для разных скелетных мышц человека оптимальный ритм колеблется в пределах от 100 до 200 импульсов в секунду.
Мышечный тонус. Мышцы в живом организме никогда, даже при покое, не бывают полностью расслабленными. Обычное состояние любой мышцы — состояние некоторого напряжения, или тонуса. Мышечный тонус вызывается редкими импульсами, поступающими в мышцы из центральной нервной системы. При тонических сокращениях мышц в отличие от тетанических обмен веществ в них заметно не повышен. Благодаря мышечному тонусу поддерживается устойчивость и положение тела.
Механизм мышечного сокращения
Мышечное сокращение происходит благодаря, скольжению актиновых нитей вдоль миозиновых (скользящее сокращение), при этом сокращается общая длина актомиозинового комплекса, без изменения длины нитей актина и миозина. Первостепенную роль в сокращении мышц играют временно замыкающиеся поперечные мостики (головки миозиновых молекул), которые и обеспечивают продвижение актиновых нитей вдоль миозиновых. Соответственно, сила мышечного сокращения будет завесить от мостиков, — чем больше прикреплено мостиков к актиновым нитям, тем сильнее сокращение.
Наряду с АТФ, важную роль в сокращении мышечного волокна играют еще ионы кальция, магния и вода.
Количество воды, которая содержит мускулатура, равняется примерно 72-80%, при этом мышечная ткань также содержит большое количество белков, и в малых количествах — гликоген, фосфолипиды, холестерин, креатинфосфат, креатин, витамины.
Чем больше мышечных волокон в скелетных мышцах, тем сильнее они будут.
 Механизм мышечного сокращения человека
Механизм мышечного сокращения человека
Коллаген
Коллаген — это основной белок соединительной ткани у животных. Коллаген содержится в костях, хрящах, сухожилиях, зубах, коже, роговице, легких, печени, кровеносных сосудах и других органах и тканях. На его долю приходится около 25-30% белка млекопитающих.
У человека и позвоночных было идентифицировано двенадцать типов коллагена, состоящего из более чем 24 различных полипептидных α-спиралей. Комбинации этих спиралей определяют типы коллагена. Например, наиболее распространенный коллаген I типа (90% общей массы коллагена) состоит из 2 спиралей α-1 и 1 α-2.
 Структура коллагена
Структура коллагена
Коллаген отличается от других белков организма своим уникальным аминокислотным составом: 33%. из всех аминокислот составляют Gly, 10% – про, 10% – гидрокси-Pro и 1% – гидрокси-Lys. Основная структурная единица коллагена — тропоколаген, состоит из трех левовращающихся α-спиралей, скрученных в одну правовращающуюся суперспираль. Такие суперспирали связываются поперечными ковалентными связями с образованием фибрилл.
Тирозин
Тирозин — ароматическая аминокислота, одна из двадцати аминокислот, необходимых для синтеза белка. Он образован из фенилаланина и других аминокислот. Тирозин участвует в синтезе адреналина, норадреналина, серотонина и дофамина.
Для правильного метаболизма тирозина в мозге необходимы витамин B 6 (пиридоксин) и фолиевая кислота. Тирозин используется для синтеза белков, катехоламинов, гормонов щитовидной железы, меланинов и может расщепляться на конечные метаболиты CO 2, H 2 O, NH + и энергию.
Между тирозином и α-кетоновой кислотой происходит реакция пераминирования, в результате чего п-гидроксифенилпируват вступает в реакцию с O 2.образуется гомогентизат. Ароматическое кольцо гомогентизата далее разрушается молекулярным кислородом с образованием малеилацетата. Он изомеризуется в фумарилацетоацетат, который гидролизуется до фумарата и ацетоацетата.
- Тирозин обладает улучшающими настроение и антидепрессивными свойствами.
- Он действует как адаптоген — улучшает адаптацию организма при стрессовых реакциях, снижает негативные последствия стресса, подавляет аппетит.
- Тирозин участвует в синтезе энкефалинов, обезболивающих.
- Используется в качестве нейротрансмиттера для стимуляции синтеза L-допа при болезни Паркинсона.
- Тирозин используется в сочетании с триптофаном и имипрамином в качестве антидепрессанта. Эти аминокислоты содержатся в соевых продуктах, курице, индейке, рыбе, бананах, молоке, сыре, семенах кунжута, овсянке.
Недостаток тирозина снижает синтез белка, отмечается повышенная утомляемость, признаки депрессии, нарушение функции печени, снижение активности щитовидной железы. Очень серьезный дефицит тирозина может возникнуть при генетическом заболевании — фенилкетонурии, при котором организм не может метаболизировать аминокислоту фенилаланин, поэтому ее необходимо исключить из рациона. В отсутствие фенилаланина тирозин не может образовываться.
 Недостаток тирозина снижает активность щитовидной железы
Недостаток тирозина снижает активность щитовидной железы






