Контрактная разработка
Содержание:
- Список литературы
- Как принимать
- Что нужно учитывать при моделировании, или откуда берутся окольные тропы
- Что такое KFU-01
- Степень успеха
- Вычислительные инициативы [ править ]
- Большие данные требуют больших усилий
- Стоимость [ править ]
- «Умные» лаборатории
- ADME-скрининг
- Оценка [ править ]
- Сокращай, оптимизируй!
- Внешние ссылки [ править ]
- Омиксные данные — новый подход в драг-дизайне
- Автоматизация фармацевтической разработки
- Доклиническое исследование лекарственных средств
- Смена скелета
Список литературы
1. Hilfiker R. Polymorphism in pharmaceutical industry. Weinheim: Wiley-VCH, 2006.
2. Бабилев Ф.В., Андроник И.Я. Полиморфизм лекарственных веществ. Кишинев: Штиинца. 1981; 239.
3. Смехова И.Е., Молдавер Б.Л., Громова Э.Г. Изучение влияния таутомерии на противовоспалительную активность бутаглионамида. Фармация. 1984; 6: 23-25.
4. Акашкина Л. В., Буленков Т.И., Езерский М.Л. Сравнительная оценка кристаллических форм стрептоцида. Научные труды. М.: 1983; XXI: 195-200.
5. Barton J.H. Reforming the patent system. Science. 2000; 287: 1933-1934.
6. Ahr G., Voith B., Kuhlmann J. Guidances related to bioavailability and bioequivalence: European industry perspective. Eur. J. Drug Metab. Pharmacokinet. 2000; 25: 25-27.
7. Ali A.A., Farouk A. Comparative studies on the bioavailability of ampicillin an- hydrate and trihydrate. Int. J. Pharm. 1981; 9: 3: 239-243.
8. Леонидов Н.Б., Успенская С.И., Гацуро В.В. Физико-химические свойства леокаина и особенности его биологической активности в сравнительном аспекте с дикаином. РХЖ. 1997; 16: 5: 53-60.
9. Майчук Ю.Ф., Щипанова А.И. Фармакодинамические характеристики тетракаина и его метастабильной модификации — леокаина как средств местной анестезии в офтальмологии. Росс. Хим. Журн. 1997; 16: 5: 61-63.
10. Леонидов Н.Б., Серезнев Н.Б., Успенская С.И. Исследование диффузионных свойств растворов полиморфных модификаций 6-метилурацила. РХЖ. 1997; 16: 5: 49-50.
11. Gu С.Н., Young V., Grant D.J.W. Polymorph screening: Influence of solvents on the rate of solvent-mediated polymorphic transformation. J. Pharm. Sci. 2001; 90: 1878-1890.
12. Brittain H.G. et al. Solid-state fluorescence studies of some polymorphs of diflunisal. J. I. Pharm. Res. 2005; 22: 6: 999-1006.
13. Решетова Е.Н., Горбунов А.А., Аснин Л.Д. Препаративное хроматографическое разделение энантиомеров ибупрофена на хиральной неподвижной фазе Whelk 01. Химико-фармацевтический журнал. 2012; 9: 47-51.
14. Лутай М.И., Лысенко А.Ф., Моисеенко О.И. Использование оптических изомеров известных сердечно-сосудистых средств — путь к повышению их эффективности и переносимости. Укр. кардіол. журн. 2009; 4: 13-20.
15. Арсеньева К.Е. Применение амлодипина в кардиологической практике. РМЖ. 2009; 17 (8): 610-613.
16. Gurjar M. The future lies in chiral purity: A perspective. J. Indian Med. Assoc. 2007; 105 (4): 177-178.
17. Rabinow В.Е. Nanosuspensions in drug delivery. Nature Rev. 2004; 3: 9: 785-796.
18. Glass B.D., Novak Cs., Brown M.E. The thermal and photostability of solid pharmaceuticals: A review J. Therm. Anal. Cal. 2004; II: 1013-1036.
19. Lennard M.S. Clinical pharmacology through the looking glass: reflections on the racemate vs enantiomer debate. Br. J. Clin. Pharmac. 1991; 31: 623-625.
20. Lien A.N., He H., Pham-Huy C. Chiral Drugs: An Overview. International Journal of Biomedical science. 2006; 2: 2: 85-100.
21. Srinivas N., Barbhaiya R.H., Midha K.K. Enantiomeric drug development: issues, considerations and reculatory requirements. J. Pharmacol. Sci. 2000; 90: 1205-1215.
22. Харитонов Ю.Я. Аналитическая химия (аналитика): в 2 кн. М.: Высшая школа, 2001; 615.
23. ICH Guidance Q6A specification: Spetifications of new drug substances and products: Chemical substances. 1999.
Как принимать
Новый препарат желательно будет принимать по назначению врача. По статистике, около двух третьих из 300 млн людей, принимающих НПВС ежегодно, не обращаются за медицинской помощью и самостоятельно принимают решение. Неудивительно, что очень часто развиваются нежелательные последствия, в первую очередь эрозии и язвы желудочно-кишечного тракта с опасными для жизни кровотечениями.
Инновационный препарат с высоким противовоспалительным и противоболевым действием лишен этих недостатков. Поэтому при самостоятельном приеме риски будут ниже. Тем не менее, экспериментировать не стоит, поэтому разработчики будут традиционно рекомендовать предварительную консультацию с врачом.
Даже если препарат позиционируется как безопасный, посоветуйтесь с врачом
Сегодня в России успешно практикуют самые разные методы лечения артроза, например трансплантацию хондроцитов. Новое лекарство от воспалений – еще одно направление. После успешных испытаний на животных медпрепарат проходит клинические исследования. Ориентировочная дата появления на рынке – 2023 года. Российские ученые рассчитывают начать продажи международных лицензий на его выпуск. Насколько приживется лекарство на нашем рынке и поможет ли при артрозе – покажет время.
Что нужно учитывать при моделировании, или откуда берутся окольные тропы
Представим, что наши вычислительные мощности невероятно велики, и мы можем проверить, оценив энергию связывания, как взаимодействуют практически все известные малые молекулы с белком-мишенью (на самом деле это далеко не так). Пусть в результате такой проверки мы выбрали некоторое количество молекул, показавших лучшие результаты. Как вы думаете, все ли они могут стать лекарствами? Чтобы ответить на этот вопрос, не проводя экспериментов с клетками и, тем более, организмами, нам нужно провести дополнительную проверку in silico. Давайте вспомним, что малая молекула должна удовлетворять эмпирически полученному «правилу пяти» Липинского (иметь менее пяти атомов-доноров водородной связи; обладать молекулярным весом меньшим 500; иметь липофильность (log P — коэффициент распределения вещества на границе раздела вода-октанол) менее 5; иметь не более 10 атомов азота и кислорода) . Нельзя также забывать и про метаболические характеристики (ADMET: всасывание, распределение, метаболизм, экскрецию, токсичность). Кроме всего этого, необходимо, чтобы молекула-кандидат была способна взаимодействовать в пространстве с активным центром мишени и удовлетворяла стерическим ограничениям. Может быть так, что потенциально активная молекула слишком большая и не может «пробраться» к активному сайту мишени, или она имеет сложную структуру, из-за чего ее очень трудно и дорого синтезировать. Другой вариант: молекула очень маленькая и «универсальная», — тогда она взаимодействует не только с нашей мишенью, но и со многими другими белками в организме человека. Это приводит к побочным эффектам, которые могут быть очень серьезными. Картина получается не самой радостной, а дорога лекарства на рынок все более запутанной. «С тех пор все тянутся передо мною кривые, глухие окольные тропы», — по словам Ёсано Акико, японской поэтессы. Хорошо, что есть способы, помогающие не запутаться в этих окольных тропах драг дизайна.
Что такое KFU-01
Молекула нового нестероидного противовоспалительного средства, запатентованная Казанским университетом, называется KFU-01. Попадая в организм человека, это пролекарство распадается под действием биохимических факторов на два активных компонента:
- напроксен (непосредственно НПВС);
- пиридоксин (форма витамина В6).
Оба компонента обладают уникальным синергетическим действием, при этом они абсолютно безопасны для пищеварения и сердечно-сосудистой системы. Исследования препарата на животных подтвердили: препарат оказывает эффективное противовоспалительное действие при остром и хроническом воспалении, а также хорошо снижает боль – не слабее, чем традиционные обезболивающие препараты.
Новый препарат не оказывает негативного воздействия на слизистую оболочку желудка
Степень успеха
Теоретически кандидаты на создание нового лекарства для лечения болезни могут включать от 5 000 до 10 000 химических соединений. В среднем около 250 из них достаточно перспективны для дальнейшей оценки с использованием лабораторных тестов, мышей и других подопытных животных. Обычно около десяти из них подходят для испытаний на людях. Исследование, проведенное Центром Тафтса по изучению разработки лекарственных средств, охватывающее 1980-е и 1990-е годы, показало, что только 21,5 процента лекарств, которые начали испытания фазы I, были в конечном итоге одобрены для продажи. За период с 2006 по 2015 год показатель успешности составил 9,6%. Высокая частота неудач, связанная с разработкой фармацевтических препаратов, называется проблемой «скорости истощения»
Чтобы избежать дорогостоящих неудач, важно принимать осторожные решения во время разработки лекарств. Во многих случаях разумная программа и дизайн клинических испытаний могут предотвратить ложноотрицательные результаты
Хорошо спланированные исследования по подбору доз и сравнения как с плацебо, так и с группой лечения золотым стандартом играют важную роль в получении надежных данных.
Вычислительные инициативы [ править ]
Новые инициативы включают партнерство между правительственными организациями и промышленностью, например, Европейская инициатива в области инновационных лекарственных средств . США пищевые продукты и медикаменты создали «Critical Path Initiative» для повышения инновационной разработки лекарственных средств, и Breakthrough терапии назначения ускорить разработку и регулирующий обзор потенциальных лекарственных средств , для которых предварительных клинических доказательств показывают , кандидат препарат может существенно улучшить терапию серьезного расстройства.
В марте 2020 года Министерство энергетики США , Национальный научный фонд , НАСА , промышленность и девять университетов объединили ресурсы для доступа к суперкомпьютерам IBM в сочетании с ресурсами облачных вычислений от Hewlett Packard Enterprise , Amazon , Microsoft и Google для открытия лекарств. . Консорциум высокопроизводительных вычислений COVID ‑ 19 также нацелен на прогнозирование распространения заболеваний, моделирование возможных вакцин и скрининг тысяч химических соединений для разработки вакцины или терапии COVID ‑ 19. В мае 2020 года было запущено партнерство OpenPandemics — COVID ‑ 19 между Scripps Research и IBM World Community Grid . Партнерство представляет собой проект распределенных вычислений, который «автоматически запустит моделируемый эксперимент в фоновом режиме , который поможет предсказать эффективность конкретного химического соединения в качестве возможного лечения COVID ‑ 19».
Большие данные требуют больших усилий
Омиксные данные в корне меняют наше представление о разработке лекарств. Вместо того чтобы исходить из уже известных механизмов заболеваний, они предлагают начать с чистого листа: собрать все, что можно, проанализировать и лишь потом делать выводы. Более того, пошаговый анализ человеком сменяется автоматизированным анализом ИИ, который может выявлять паттерны и взаимосвязи мишень—кандидат, неподвластные человеческому разуму.
Многомерность — отличительная черта омиксных данных: сравнивая генетические профили тканей больных и здоровых людей, на выходе получаем сотни, а иногда тысячи дифференциально экспрессируемых генов. И чтобы понять, что же именно это значит, необходим очень мощный анализ сигнальных путей, который превратил бы сырые неструктурированные данные в несколько ключевых и легко интерпретируемых характеристик. Есть разные вариации таких методов , но суть одна — сосредоточиться на тех путях, молекулы-участники которых наиболее важны для понимания заболевания и определения мишеней.
Омиксные данные и их анализ едва ли облегчают учесть исследователей: теперь помимо знания командной строки Linux важно не только различать supervised и unsupervised learning, но и молекулярные пути не забывать. Ведь без биологически релевантной интерпретации таких данных — это просто набор молекул
Но, вероятно, именно так получится разрабатывать лекарства быстрее, дешевле и надежнее.
Стоимость [ править ]
В одном исследовании 2010 года капитализированные и наличные затраты на вывод на рынок одного нового препарата оценивались примерно в 1,8 млрд долларов США и 870 млн долларов США соответственно. медиана смета расходов 2015-16 гг испытаний для разработки 10 противораковых препаратов была 648000000 $. В 2017 году средняя стоимость основного исследования по всем клиническим показаниям составила 19 миллионов долларов.
Средняя стоимость (в долларах 2013 г.) каждого этапа клинических исследований составляла 25 миллионов долларов США для исследования безопасности фазы I, 59 миллионов долларов США для рандомизированного контролируемого исследования эффективности фазы II и 255 миллионов долларов США для основного исследования фазы III, чтобы продемонстрировать его эквивалентность или превосходство. к существующему одобренному препарату , возможно, до 345 миллионов долларов. Средняя стоимость проведения основного исследования фазы III в 2015–16 годах на кандидате от инфекционного заболевания составила 22 миллиона долларов.
Полная стоимость вывода на рынок нового лекарства (т. Е. Нового химического соединения ) — от открытия через клинические испытания до утверждения — сложна и спорна. В обзоре, проведенном в 2016 году с участием 106 кандидатов в лекарственные препараты, оцененных в ходе клинических испытаний, общие капитальные затраты для производителя, имеющего препарат, одобренный в результате успешных испытаний фазы III, составили 2,6 миллиарда долларов (в долларах 2013 года). сумма увеличивается ежегодно на 8,5%. В период 2003–2013 гг. Для компаний, которые одобрили 8–13 препаратов, стоимость одного препарата может вырасти до 5,5 млрд долларов, в основном из-за международной географической экспансии на маркетинг и текущих затрат наИспытания фазы IV для непрерывного наблюдения за безопасностью .
Альтернативы разработке традиционных лекарств имеют целью объединить университеты, правительства и фармацевтическую промышленность и оптимизировать ресурсы.
«Умные» лаборатории
Следующий шаг в автоматизации разработки лекарств — объединение всех лабораторных устройств в одну систему, контролируемую общим программным обеспечением . В идеале — это объединение всех этапов, описанных выше, от моделирования in silico до доклинических экспериментов. Сейчас на практике такая автоматизация пока нереальна, но в некотором приближении похожие примеры уже есть.
Для этого лабораторные устройства, вплоть до дозаторов, оснащаются датчиками, что позволяет следить за всеми стадиями эксперимента от начала до конца . Такой подход называется Internet of Things (IoT, «интернет вещей») и, по некоторым расчетам, позволит повысить продуктивность лабораторий на 30–40% . Согласно исследованиям, человеческий фактор, ошибки и несоблюдение протоколов — основная причина неэффективности лабораторий в фармкомпаниях. В среднем действия выполняются лаборантами правильно в 92% случаев. Кажется, что это неплохо, но эти 8% ошибок накладываются друг на друга, приводя к заметной потере эффективности.
Объединение баз данных, электронных дневников, данных с датчиков и приборов в одну «умную лабораторию» (smart lab) позволило бы сэкономить на рутинных действиях и отслеживании человеческих ошибок и сосредоточиться на более продуктивных вещах.
Важная предпосылка к интеграции всех систем и обеспечению единого потока автоматических процессов от синтеза веществ до получения лекарственных кандидатов и дальше, к тестированию in vivo — модульность автоматических систем . Многие компании уже сделали шаги в этом направлении, как, например, AstraZeneca со своей платформой NiCoLab .
Одним из интересных подходов к объединению разных стадий процесса разработки лекарств может стать использование библиотек с ДНК-кодами — DNA-encoded libraries. Здесь во время синтеза соединений из блоков (как на рис. 2) к растущей структуре основного соединения добавляются ДНК-метки, которые кодируют то, из каких блоков состоит вещество (рис. 11).
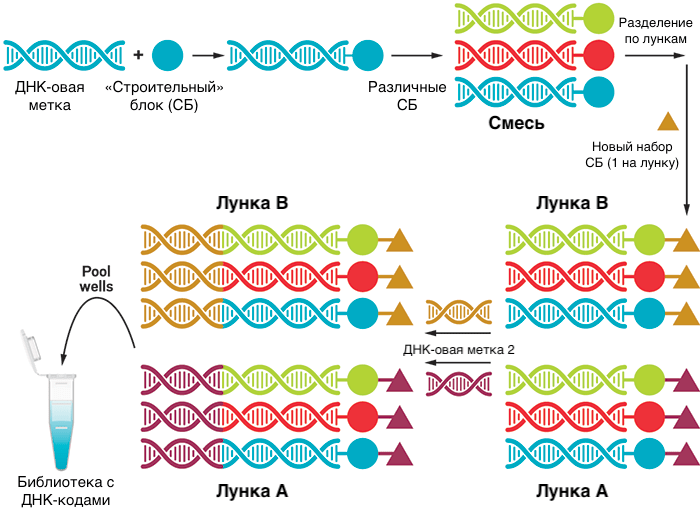
Рисунок 11а. Создание библиотеки с ДНК-кодами и ее применение в скрининге лекарственных препаратов
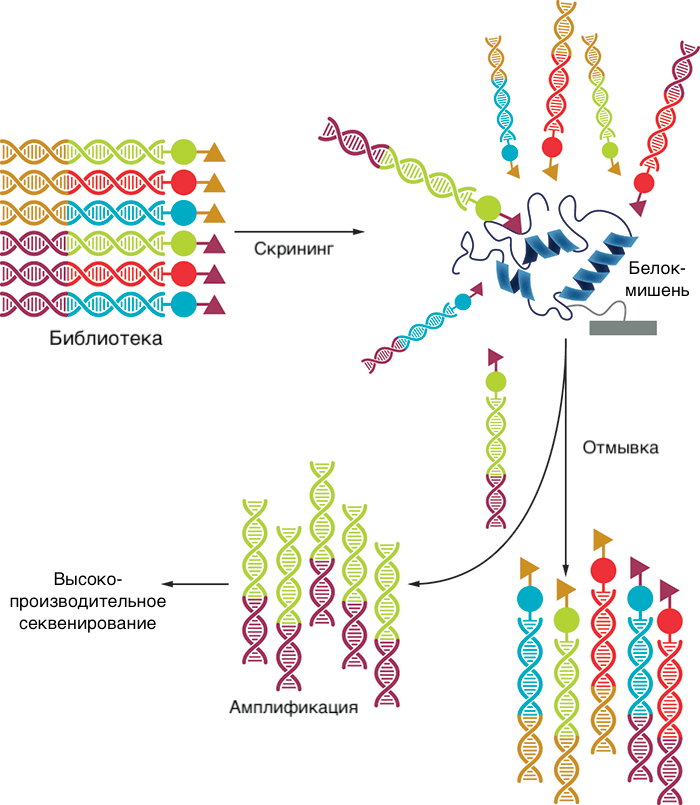
Рисунок 11б. Создание библиотеки с ДНК-кодами и ее применение в скрининге лекарственных препаратов
Затем вся библиотека в одной пробирке (а веществ там могут быть миллионы) отправляется на скрининг. Вещества, связавшиеся с мишенью, отделяют и отправляют на секвенирование привязанных к ним меток (иногда проводят два или три раунда связывания с мишенью, чтобы остались только высокоспецифичные лиганды). Это очень сокращает время, реагенты и усилия, затрачиваемые на скрининг. Таким образом удобно, например, находить селективные ингибиторы ферментов, потому что можно провести скрининг большого числа соединений не только против самой мишени, но и против близких к ней белков, с которыми лекарство не должно связываться. Это довольно актуально при поиске киназных ингибиторов, потому что у множества киназ похожие сайты.
Правда, у этого остроумного метода есть и недостатки: во-первых, ДНК-овый «хвост» может влиять на связывание вещества с мишенью вплоть до полного препятствования. Поэтому этот метод может упустить хороших кандидатов, которые могли бы связаться с мишенью, не будь к ним пришита ДНК. Во-вторых, из-за наличия ДНК реакции приходится проводить только в водной среде, что ограничивает круг возможных соединений. В-третьих, после нахождения хитов приходится синтезировать их снова без участия ДНК, что требует отдельного подбора условий.
Тем не менее метод уже показал первые успехи: полученные на его основе соединения находятся на ранних стадиях клинических исследований. А одна из компаний-лидеров в этой области сообщила о создании библиотеки с 40 триллионами (!) соединений . Есть из чего выбрать…
ADME-скрининг
После получения лидов — веществ с достаточно высокой специфичностью и селективностью по отношению к мишени и показавших хорошие результаты в функциональных тестах — наступает этап их оптимизации (lead optimization), на котором в первую очередь улучшают фармакокинетические свойства будущего лекарственного кандидата (грубо говоря, то, как организм будет воздействовать на лекарство). Основные параметры поведения лекарства в организме — ADME, то есть, как уже говорилось, адсорбция, распределение, метаболизм, выведение, а также токсичность (поэтому иногда используют аббревиатуру ADMET). Хотя на первый взгляд кажется, что поведение веществ в пробирке имеет мало отношения к ситуации в организме, однако двадцатилетний опыт исследования ADMET показал, что тщательное изучение этих параметров in vitro и отсев бесперспективных соединений позволяет значительно снизить риски провала в клинических исследованиях в будущем, а, значит, сэкономить время и деньги.
- взаимодействие с цитохромами для определения потенциальных путей метаболизма и лекарственных взаимодействий;
- взаимодействие с многочисленными транспортерами в кишечнике, гематоэнцефалическом барьере, печени и почках для выяснения путей распределения и экскреции, а также для предсказания лекарственных взаимодействий;
- связывание с белками плазмы крови, ЦНС и других тканей;
- клеточные тесты на проникновение через кишечный эпителий, в печень, ЦНС;
В центре автоматизации ADMET, конечно, стоит робот-диспенсер, раскапывающий кандидатное вещество, а ключевой детектирующий прибор, на котором происходит определение производных веществ, — это тандемный масс-спектрометр с жидкостной хроматографией (LC-MS/MS). Здесь важным шагом вперед в повышении производительности стало применение мультиплексных приборов, когда несколько независимых хроматографов присоединяется к одному входу масс-спектрометра. Это и другие технические ухищрения (нанолитровые дозаторы, акустические генераторы капель) позволили довести среднее время анализа до 5 секунд на образец .
Всё большую роль в высокопроизводительном тестировании ADMET играют технологии трехмерных культур тканей и organ-on-a-chip (орган-на-чипе), которые позволяют смоделировать ситуацию в организме с лучшим приближением, нежели культуры клеток. Технологии organ-on-a-chip объединяют микрофлюидику и тканевую инженерию для создания моделей заболеваний, которые проще в обращении и более предсказуемы, чем живые организмы, но ближе к живым организмам, чем клетки в чашке Петри. Органы на чипе позволяют имитировать механические, химические и физические воздействия на ткани в организме и четко контролировать экспериментальные условия. Одним из первых примеров такой технологии стала имитация интерфейса между альвеолой и легочным капилляром (рис. 10). Эпителиальные и эндотелиальные клетки культивировали по разные стороны эластичной полупроницаемой мембраны. По бокам от центрального канала находятся вакуумные камеры. При снижении в них давления мембрана с клетками растягивается, имитируя натяжение поверхности альвеол при дыхании. Это меняет проницаемость слоя с клетками для лекарств, воздуха и других веществ, позволяя исследовать систему в условиях, имитирующих реальные.
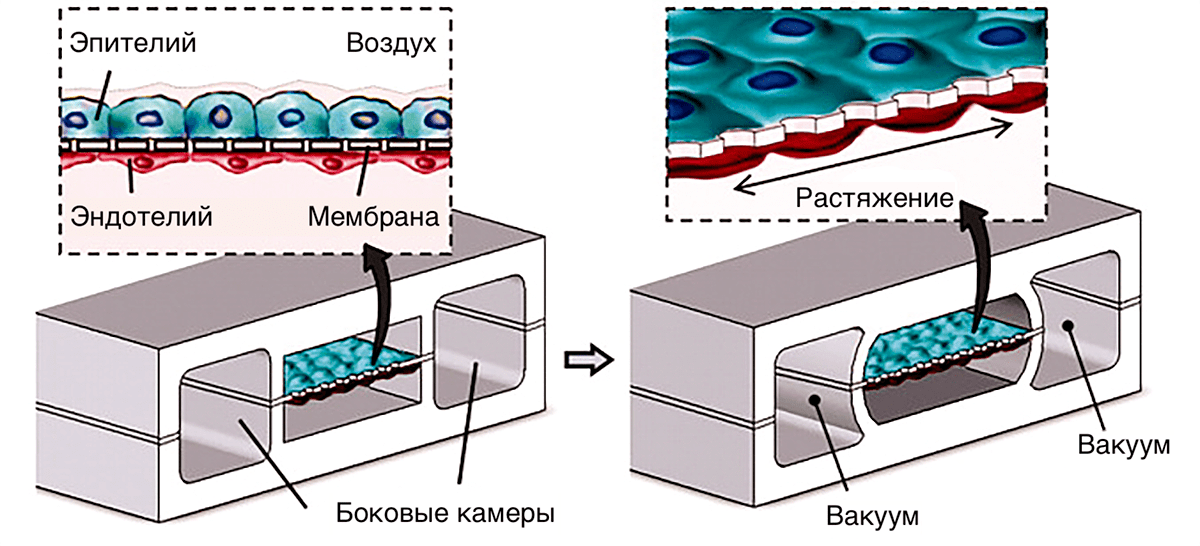
Рисунок 10. Пример органа-на-чипе, имитирующего интерфейс между альвеолой и легочным капилляром, сконструированный с учетом механических воздействий
Пока что органы-на-чипе не стали стандартным этапом разработки лекарств, но, учитывая тенденцию к миниатюризации, снижению истребления животных и, опять же, автоматизации, у этой технологии большое будущее.
Оценка [ править ]
Природа проекта разработки лекарств характеризуется высоким уровнем выбытия , большими капитальными затратами и длительными сроками. Это делает оценку таких проектов и компаний сложной задачей. Не все методы оценки могут справиться с этими особенностями. Наиболее часто используемые методы оценки — это чистая приведенная стоимость с поправкой на риск (rNPV), деревья решений , реальные опционы или сопоставимые активы .
Наиболее важными факторами стоимости являются стоимость капитала или используемая ставка дисконтирования, атрибуты фазы, такие как продолжительность, процент успеха и затраты, а также прогнозируемые продажи, включая стоимость товаров, а также расходы на маркетинг и продажи. Менее объективные аспекты, такие как качество управления или новизна технологии, должны быть отражены в оценке денежных потоков .
Сокращай, оптимизируй!
Из тысяч доступных веществ с более-менее определенными свойствами необходимо выбрать сотни молекул, способных после дальнейшей модификации и испытаний на бактериях или культурах клеток дать десятки так называемых кандидатных соединений, предназначенных для доклинических исследований, включая тестирование на животных.
Оптимизация может заключаться в «отсечении» части известного лиганда, или наоборот, добавлении к нему новых элементов и новой проверке на взаимодействие с мишенью. Возвращаясь к аспирину: он получился из салициловой кислоты путем добавления ацетильной группы.
Внешние ссылки [ править ]
| vтеДизайн лекарств | |
|---|---|
| Шаги в дизайне |
|
| Тематические исследования открытия и разработки классов наркотиков |
|
Омиксные данные — новый подход в драг-дизайне
Омиксные данные — большие массивы данных, собранные на разных уровнях биологических процессов. В целом «-омики» (от англ. ) — это новые биологические дисциплины, объединенные своим подходом к методологии изучения биообъектов: изучить не один или несколько генов, а все гены сразу (геномика), или все белки (протеомика), транскрипты (транскриптомика), метаболиты (метаболомика) и так далее. Мы уже разбирали философию такого подхода в статье «“Омики” — эпоха большой биологии» . К ней и адресуем читателя, который еще не совсем понял, что к чему.
Так, омиксные данные — это совокупность всех молекул определенного уровня, отражающая состояние организма или его части. Омиксные технологии используют высокопроизводительные (high-throughput) методы, что ведет за собой производство больших массивов данных. Для их анализа необходимы определенные компьютерные методы, что породило создание новой дисциплины на стыке биологии, статистики и компьютерной науки — биоинформатики . Как правило, эти специалисты — биологи с прокаченными компьютерными навыками, которые не боятся командной строки UNIX/Linux и вовсю используют язык программирования R. Однако и этого уже становится недостаточно. Способность применения методов машинного обучения для решения биологических задач — требование-тренд, обещающий выжать все информационные соки из омиксных данных (подробнее — в следующей части статьи).
На данный момент основная сфера применения омиксных данных в контексте драг-дизайна — ранние фазы доКИ. Здесь выделяются два направления. Первое — оценка характеристик терапевтических молекул-кандидатов с помощью данных, получаемых из клеток. В этом случае клетки становятся источниками омиксной информации, которую мы используем для оценки характеристик потенциальных лекарств-кандидатов. Второе направление — поисковые доКИ. Здесь речь идет о получении «слепка» состояния организма при заболевании на определенном уровне (или нескольких сразу) и попытках воздействия на него лекарственными средствами. Классический пример применения омиксных данных одного уровня — сравнение транскриптома ткани больных людей и здоровых. Мы сравниваем экспрессию генов тех и других и делаем выводы о молекулярных путях, регуляция которых нарушена при заболевании.
Далее выбираются молекулы-мишени (например, белки, синтез которых значительно повышен при заболевании) и подбираются молекулы-кандидаты, способные воздействовать на них. В последнее время, однако, все чаще исследователи прибегают к интеграции омиксных данных разных уровней — анализу мультиомиксных (multi-omics, или cross-omics) данных (рис. 1). Этому есть простое объяснение: любой процесс в клетке (в том числе патологический) охватывает различные уровни ее молекулярной организации, тем самым находя отражение во множестве типов омиксных данных. Поэтому, собрав и интегрировав данные сразу о последовательностях ДНК, РНК, пептидах, белках, метаболитах и т.д., можно воссоздать более полную картину заболевания и повысить вероятность успеха подбора терапевтических молекул.
Разберем подробнее оба направления применения омиксных данных в доКИ.
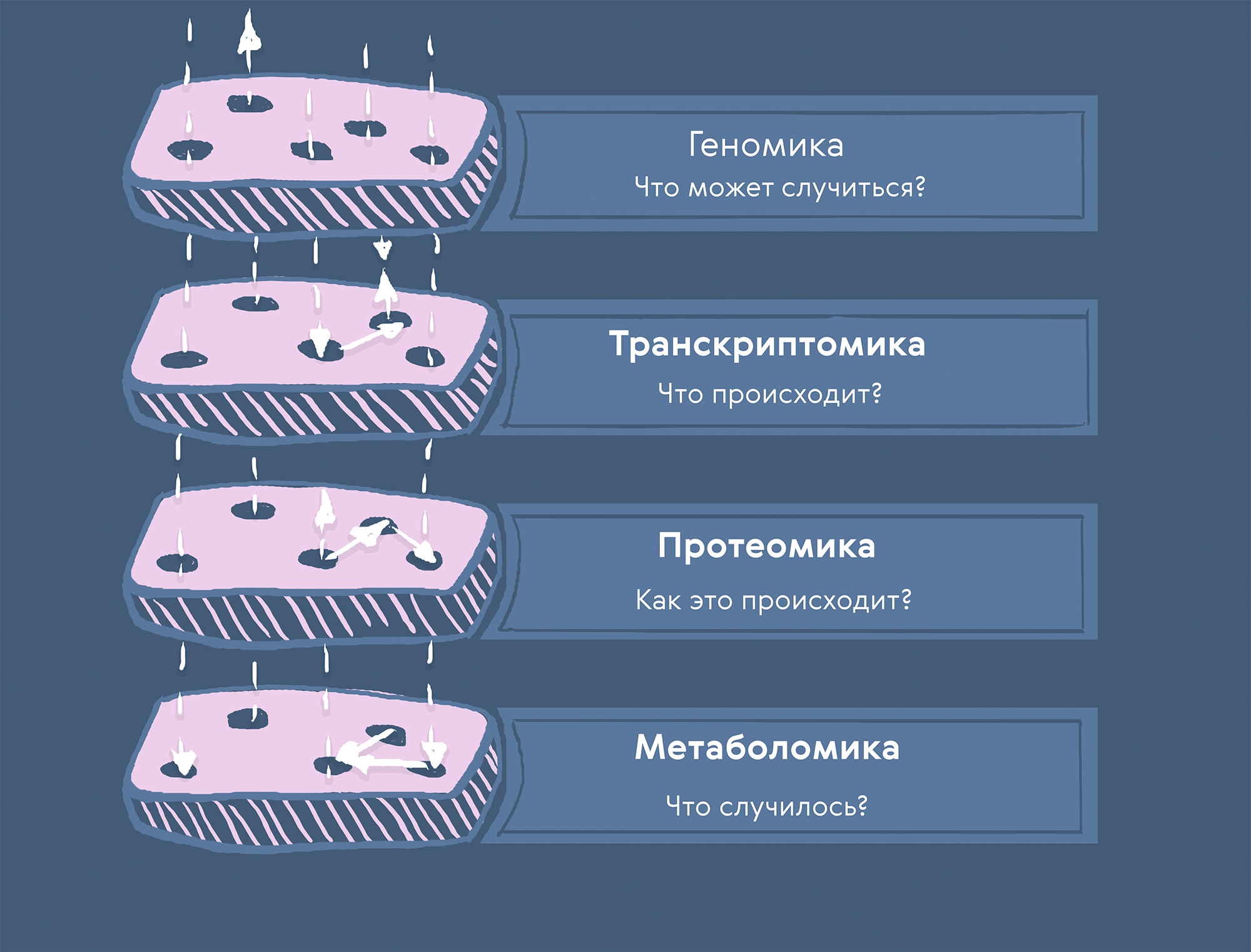
Рисунок 1. Цели мультиомиксных данных по уровням. Геномные данные отвечают на вопрос «что может случиться?»; транскриптомные — «что происходит?»; протеомные — «как это происходит?»; метаболомные — «что случилось?».
Автоматизация фармацевтической разработки
Для создания лекарства недостаточно просто иметь вещество с нужными характеристиками, которые изучаются в ходе этапов получения и оптимизации лида (см. рис. 1). Нужно в итоге обеспечить производство этого вещества и вместе со вспомогательными компонентами объединить его в готовую лекарственную форму (таблетку, раствор для инъекции, крем и др.). Этим занимаются в ходе фармацевтической разработки, которая, конечно, тоже нуждается в автоматизации.
«Биомолекула» касалась аспектов обеспечения качества лекарственных продуктов в статьях «Контроль качества биотехнологических продуктов» и «Генные и клеточные лекарства: сложное регулирование для сложных продуктов» . В первой статье также вкратце рассказывается о концепции Quality by Design.
Один из тонких моментов фармацевтической разработки — создание формуляции, то есть состава готовой лекарственной формы препарата. Для этого может потребоваться перебор множества вариантов вспомогательных веществ, их концентраций и т.д. На раннем этапе фармацевтической разработки требуется выбрать оптимальный вариант и с точки зрения стабильности, и с точки зрения масштабируемости, и с точки зрения обеспечения наилучших параметров эффективности и безопасности. В дальнейшем формуляцию можно будет изменить, но чем позднее это произойдет, тем больше усилий потребуется.
Другой аспект фармацевтической разработки, требующий аккуратной постановки множества однотипных экспериментов, — валидация процесса производства и аналитических методов контроля качества. Валидация, упрощенно говоря, — доказательство того, что процесс делает то, что от него требуется. То есть, по большому счету, это научный эксперимент, только его методология четко прописана в руководствах, а отчеты о валидации внимательно изучаются регуляторными органами. Процессам и методикам, не прошедшим валидацию, не следует доверять, так как они могут приводить к получению продуктов ненадлежащего качества.
Также хорошо поддаются автоматизации эксперименты по изучению стабильности лекарственных продуктов, которые должны проводиться при различных температурах, освещенности, влажности и т. п. Так, например, для вакцины «Спутник V» сначала была выпущена форма, хранящаяся при −20 °C, потому что эксперименты по хранению и стабильности при более высоких температурах еще не были проведены. Когда они закончились, была выпущена форма, хранящаяся при +2 … +8 °C. Понятно, что никто не проводит эксперименты два года для обоснования двухлетнего срока хранения. Такой срок получается после экстраполяции результатов экспериментов по ускоренной деградации лекарств при повышенных температурах. То есть, например, информацию о стабильности при −20 °C получают из эксперимента по ускоренному хранению при 0 °C.
Доклиническое исследование лекарственных средств
Доклинические исследования — научное изучение лекарственных компонентов или препаратов, в ходе которого можно получить первичные данные об их безопасности и эффективности. Обязательный этап регистрации лекарств для медицинского применения, необходимый для регистрации лекарства для медицинского применения и его вывода на рынок в Российской Федерации.
Основные принципы проведения доклинических исследований размещены в ст. 11 закона N 61-ФЗ.
Их цель — получить реальную оценку эффективности фармакологического вещества и его комбинаций, определить методики для дальнейшего изучения и параметры для контроля. В ходе доклинических исследований изучаются различные показатели: химические, физические, токсикологические, биологические, фармакологические, микробиологические и другие. В результате делается вывод о целесообразности клинических испытаний, в ходе которых препарат проверяется на человеке.
Изучение лекарственного вещества проходит в научно-исследовательских организациях и лабораториях, оснащённых подходящей под эти задачи материально-технической базой и имеющих квалифицированных специалистов в этой области.
Специалисты строят свою работу по специальному плану, который должен утвердить разработчик лекарства. По мере получения результатов вся информация фиксируется в протоколе, который в дальнейшем войдёт в брошюру исследователя и будет использован при составлении регистрационного досье.

При проведении доклинических испытаний препаратов специалисты создают модель воздействия вещества на лабораторных животных. При этом оцениваются общая и хроническая токсичность, фармакодинамика, фармакокинетика, специфическая токсичность.
Общая токсичность — наличие побочных эффектов при разных дозировках.
Хроническая токсичность — наличие побочных эффектов при многократном употреблении вещества в течение определённого промежутка времени.
Специфическая токсичность — иммунотоксичность, мутагенность, канцерогенность и аллергенность средства.
Фармакодинамика — изучение биологических механизмов, локализации и эффектов взаимодействия веществ.
Фармакокинетика — изучение особенностей всасывания, распределения в организме и выведения вещества.
После проведения доклинических процедур, при успешном их результате лекарственное средство поступает на стадию клинических испытаний.
Смена скелета
Когда вы нашли молекулу-кандидат в лекарства, нужно провести оптимизацию, улучшить ее свойства, чтобы увеличить вероятность успеха при экспериментальной проверке. Рассматривая молекулу-кандидат (лиганд) мы можем выделить в ней важные для взаимодействия с белком-мишенью части, структурную основу — скелет — и другие группы, предположительно не участвующие в интересующем нас взаимодействии или даже мешающие контакту лиганда с мишенью. Смена скелета (scaffold hopping) нужна, когда мы хотим сохранить важные для взаимодействия с мишенью части лиганда и заменить остальные на более подходящие. Конечно же, необходимо при этом учитывать изменение энергии связывания лиганда с мишенью. Кроме этого, изменяются конформационные свойства лиганда, что сказывается на энтропии взаимодействия.
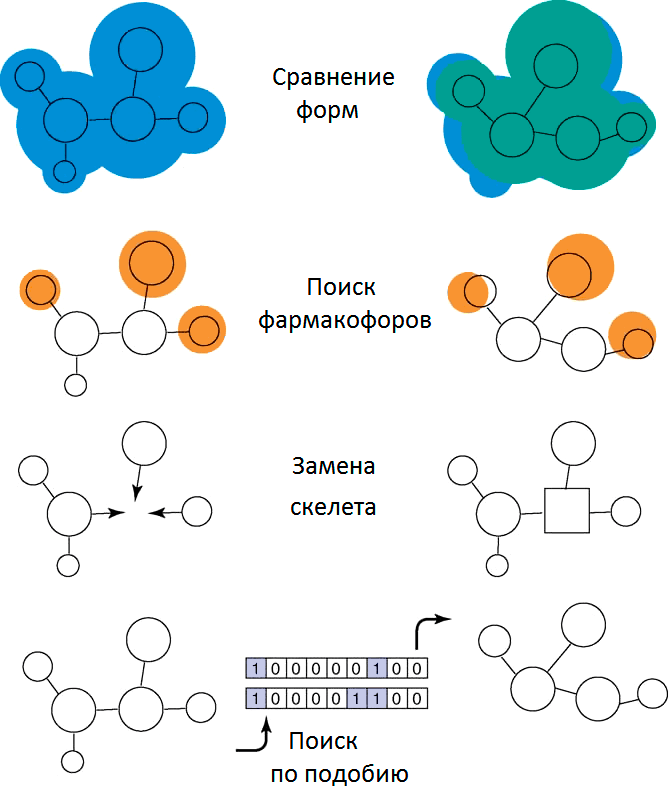
Рисунок 1. Принцип «смены скелета»: совпадение форм, поиск особых групп, определяющих свойства, сама смена скелета, поиск по подобию.
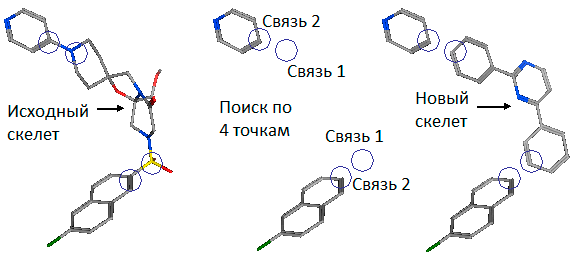
Рисунок 2. Исходная молекула и молекула — результат смены скелета
При смене скелета мы получаем много новых вариантов, среди которых выбираем лучшие, наиболее нам подходящие по трехмерной структуре, энтропии, энергии связывания с белком-мишенью и другим характеристикам. Смена скелета лиганда расширяет нам поле возможностей, дает множество вариаций. Как будто у нас есть набор фрагментов конструктора, и мы хотим собрать некоторую упорядоченную и стабильную структуру (используя эти фрагменты и некоторые связующие их), чтобы потом присоединить ее к чему-нибудь еще. Как будто мы потеряли один крайний кусочек паззла, но знаем, что должно быть в том месте, которым он присоединяется к картине, в результате чего делает ее завершенной. Таким образом, мы можем, например, из большого и трудносинтезируемого лиганда сделать маленький, хорошо способный пробираться к сайту связывания. Словно вырезать из картона недостающий кусочек паззла, отбросив все лишнее.
Есть еще одна интересная область применения смены скелета, связанная с так называемыми опережающими патентами. Такие патенты выдаются на некоторое время компаниям, утверждающим о наличии некоторой лекарственной активности у определенной молекулы. В течение этого времени они должны доказать, что эта активность действительно есть. А что же делать вам, если вы сами нашли активность у этой молекулы и хотите запатентовать ее? Когда вы делаете смену скелета, результатом является уже другая молекула, не закрытая патентом, но обладающая интересующей биологической активностью , .






