Пентозофосфатный путь окисления глюкозы
Содержание:
- Cited by 448 articles
- Функция
- Описание фермента
- What is NADP?
- What is the Difference Between NAD and NADP?
- Клиническое значение
- Биосинтез
- Что такое НАДХ
- Что такое НАДП +
- Обмен витамина РР в организме
- Health Benefits of NADPH and NADPH Oxidase
- Функция [ править ]
- Разница между NAD + и NADP +
- Сходства между NAD + и NADP +
- Что такое НАД +
- Что такое НАДХ
- Функция
- Сотовая роль
- Что такое НАДФН?
- В чем разница между НАД и НАДФ?
- What is NADP+
- Функция [ править ]
- Главное отличие — НАД против НАДП
Cited by 448 articles
-
Raman Imaging and Fluorescence Lifetime Imaging Microscopy for Diagnosis of Cancer State and Metabolic Monitoring.
Becker L, Janssen N, Layland SL, Mürdter TE, Nies AT, Schenke-Layland K, Marzi J.
Becker L, et al.
Cancers (Basel). 2021 Nov 13;13(22):5682. doi: 10.3390/cancers13225682.
Cancers (Basel). 2021.PMID: 34830837
Free PMC article.Review.
-
Simultaneous NAD(P)H and FAD fluorescence lifetime microscopy of long UVA-induced metabolic stress in reconstructed human skin.
Ung TPL, Lim S, Solinas X, Mahou P, Chessel A, Marionnet C, Bornschlögl T, Beaurepaire E, Bernerd F, Pena AM, Stringari C.
Ung TPL, et al.
Sci Rep. 2021 Nov 12;11(1):22171. doi: 10.1038/s41598-021-00126-8.
Sci Rep. 2021.PMID: 34772978
Free PMC article. -
Regulation of NAD+ metabolism in aging and disease.
Chu X, Raju RP.
Chu X, et al.
Metabolism. 2022 Jan;126:154923. doi: 10.1016/j.metabol.2021.154923. Epub 2021 Oct 28.
Metabolism. 2022.PMID: 34743990
Review.
-
The metabolic adaptation evoked by arginine enhances the effect of radiation in brain metastases.
Marullo R, Castro M, Yomtoubian S, Calvo-Vidal MN, Revuelta MV, Krumsiek J, Cho A, Morgado PC, Yang S, Medina V, Roth BM, Bonomi M, Keshari KR, Mittal V, Navigante A, Cerchietti L.
Marullo R, et al.
Sci Adv. 2021 Nov 5;7(45):eabg1964. doi: 10.1126/sciadv.abg1964. Epub 2021 Nov 5.
Sci Adv. 2021.PMID: 34739311
Free PMC article. -
Interplay between ADP-ribosyltransferases and essential cell signaling pathways controls cellular responses.
Boehi F, Manetsch P, Hottiger MO.
Boehi F, et al.
Cell Discov. 2021 Nov 2;7(1):104. doi: 10.1038/s41421-021-00323-9.
Cell Discov. 2021.PMID: 34725336
Free PMC article.Review.
Функция
НАДФН обеспечивает восстановительные эквиваленты для биосинтетических реакций и окислительно-восстановительных реакций, участвующих в защите от токсичности активных форм кислорода (АФК), обеспечивая регенерацию глутатиона (GSH). НАДФН также используется для анаболических путей, таких как синтез холестерина, синтез стероидов, синтез аскорбиновой кислоты, синтез ксилита, синтез цитозольных жирных кислот и удлинение цепи микросомальных жирных кислот .
Система НАДФН также отвечает за образование свободных радикалов в иммунных клетках с помощью НАДФН-оксидазы . Эти радикалы используются для уничтожения патогенов в процессе, называемом респираторным взрывом . Это источник восстановительных эквивалентов для цитохрома P450 гидроксилирования из ароматических соединений , стероидов , спиртов и наркотиков .
Описание фермента
Расположение
На клеточном уровне функциональный комплекс НАДФН-оксидаза (NOX2) расположен по-разному в зависимости от функции клетки, в которой он участвует. Например, он будет на уровне фаголизосомной мембраны (в результате слияния фагосомы и лизосомы в макрофагах) или фагосом (нейтрофилов) во время фагоцитоза, что будет способствовать разрушению фагоцитированного тела. Активация также может происходить на плазматической мембране, в частности, в случае воспалительных процессов.
Подразделения
НАДФН-оксидаза состоит из шести субъединиц, сгруппированных вместе, чтобы сформировать ферментный комплекс на уровне плазматической мембраны фаголизосомы. Эта ассоциация позволяет окислять НАДФН до НАДФ +, что приводит к синтезу АФК.
Цитохром b558
Цитохром b558 интегрирован в мембрану, состоящую из двух субъединиц: p22phox и Nox2.
В покоящихся нейтрофилах большая часть цитохрома b558 сосредоточена в определенных гранулах. После активации нейтрофила гранулы сливаются с мембраной фагосомы.
Рэп 1А
Rap 1A представляет собой небольшой белок размером 22 кДа G, очень распространенный в нейтрофилах. Малые G-белки связывают GTP ( гуанозинтрифосфат ) / GDP ( гуанозиндифосфат ). Они активны, когда связаны с молекулой GTP. Rap1A связан с цитохромом b558 в нейтрофилах. В своей активной форме (связанный с GTP) Rap1A более прочно связывается с цитохромом b558. Роль Rap1A еще четко не выяснена. Это может быть регулятор НАДФН-оксидазы.
Субъединица P67phox
Фактор p67phox является «активатором» оксидазного комплекса. Его связь с цитохромом b558 важна для оксидазной активности.
Субъединица P40phox
Совсем недавно Важность p40phox в продукции O2- (супероксид-иона) была подтверждена в контексте активации, индуцированной фагоцитозом через рецептор FcγR. В этих условиях белок p40phox не важен в процессе сборки, а скорее в регуляции активности после полной сборки на уровне фагосом.
Подразделение RAC
Белок Rac, член небольшого семейства GTPase, является важным элементом для активности оксидазы, когда он находится в своей GTP-связанной форме.
Существует прямая связь между Rac и цитохромом b558. В состоянии покоя Rac является цитоплазматическим и связан с белком RhoGDI (ингибитор диссоциации GDP), который поддерживает его в неактивной форме, связанной с GDP. Активация нейтрофила вызывает диссоциацию RhoGDI, позволяя обменять GDP посредством GTP, превращая Rac в активную конформацию, позволяя его перемещать на мембрану.
Функционирование
Эти последовательные реакции с участием АФК приводят к более низкой концентрации ингибиторов протеаз и, следовательно, к повышению активности протеаз. Таким образом, облегчается разрушение фагоцитированного элемента.
Диаграмма баланса NOX2
What is NADP?
NADP is another important cofactor in living cells that predominantly participate in anabolic metabolism. NADP exists in two forms: oxidized form NADP+ and reduced form NADPH. Moreover, NADP synthesis occurs via the phosphorylation of NAD by NADK (NAD Kinase).

Figure 02: NADP
In animals, it is a vital molecule of the cellular oxidative defence system and reductive synthesis. NADP molecules play an important role in maintaining a pool of reducing equivalents that is essential to counteract oxidative damage and for other detoxifying reactions. NADPH system can produce free radicals in immune cells that are essential to destroy pathogens in the body. Furthermore, NADP molecules participate in metabolic pathways such as lipid and cholesterol synthesis, and fatty acid elongation in animal cells.
In plants and other photosynthetic organisms, NADPH synthesis takes place in the last step of the electron chain of the light reaction of photosynthesis by ferredoxin-NADP+ reductase enzyme. These NADP then work as the reducing power in the Calvin cycle to assimilate carbon dioxide in plants.
What is the Difference Between NAD and NADP?
NAD and NADP are relative coenzymes. NAD is a coenzyme of living cells that participates mainly in redox reactions of cellular respiration. On the other hand, NADP is another important coenzyme that predominantly participates in redox reactions of anabolic metabolism. So, this is the key difference between NAD and NADP.
Moreover, NADP has an additional phosphate group while this additional phosphate group is absent in the NAD molecule. So, it is also a significant difference between NAD and NADP. Besides, NAD production occurs either in a ‘de novo’ pathway from amino acids or in salvage pathways by recycling nicotinamide back to NAD. On the other hand, NADP biosynthesis requires phosphorylation of NAD catalyzed by NAD kinase. Therefore, we can consider this as another difference between NAD and NADP.
The below infographic summarizes more information on the difference between NAD and NADP.

Клиническое значение
Ферменты, которые производят и используют НАД + и НАДН, важны как для фармакологии, так и для исследования будущих методов лечения болезней. При разработке и разработке лекарств НАД + используется тремя способами: как прямая мишень для лекарств, путем разработки ингибиторов или активаторов ферментов на основе его структуры, которые изменяют активность НАД-зависимых ферментов, и путем попытки подавить биосинтез НАД + .
Поскольку раковые клетки используют повышенный гликолиз , и поскольку НАД усиливает гликолиз, никотинамидфосфорибозилтрансфераза (путь спасения НАД) часто усиливается в раковых клетках.
Он был изучен на предмет его потенциального использования в терапии нейродегенеративных заболеваний, таких как болезнь Альцгеймера и Паркинсона . Плацебо-контролируемое клиническое исследование НАДН (которое исключало предшественники НАДН) у людей с болезнью Паркинсона не продемонстрировало какого-либо эффекта.
NAD + также является прямым объектом препарата изониазид , который используется при лечении туберкулеза , инфекции , вызванной микобактерий туберкулеза . Изониазид является пролекарством, и, как только он попадает в бактерии, он активируется ферментом пероксидазой , который окисляет соединение до свободнорадикальной формы. Затем этот радикал вступает в реакцию с NADH с образованием аддуктов, которые являются очень мощными ингибиторами ферментов еноилацил-носителя протеин-редуктазы и дигидрофолатредуктазы .
Поскольку большое количество оксидоредуктаз используют NAD + и NADH в качестве субстратов и связывают их с помощью высококонсервативного структурного мотива, идея о том, что ингибиторы на основе NAD + могут быть специфичными для одного фермента, является неожиданной. Однако это возможно: например, ингибиторы на основе соединений микофеноловой кислоты и тиазофурина ингибируют дегидрогеназу IMP в сайте связывания NAD +
Из-за важности этого фермента в метаболизме пуринов эти соединения могут быть полезны в качестве противораковых, противовирусных или иммунодепрессивных лекарств. Другие препараты не являются ингибиторами ферментов, а вместо этого активируют ферменты, участвующие в метаболизме НАД +
Сиртуины являются особенно интересной мишенью для таких лекарств, поскольку активация этих НАД-зависимых деацетилаз увеличивает продолжительность жизни в некоторых моделях животных. Такие соединения, как ресвератрол, увеличивают активность этих ферментов, что может иметь важное значение в их способности замедлять старение как у позвоночных, так и у беспозвоночных модельных организмов . В одном эксперименте у мышей, получавших НАД в течение одной недели, улучшилась ядерно-митохрондриальная связь.
Из-за различий в метаболических путях биосинтеза НАД + между организмами, например между бактериями и людьми, эта область метаболизма является многообещающей областью для разработки новых антибиотиков . Например, фермент никотинамидаза , который превращает никотинамид в никотиновую кислоту, является мишенью для разработки лекарств, поскольку этот фермент отсутствует у людей, но присутствует в дрожжах и бактериях.
В бактериологии НАД, иногда называемый фактором V, используется в качестве добавки к питательной среде для некоторых привередливых бактерий.
Биосинтез
НАДФ +
Как правило, НАДФ + синтезируется раньше, чем НАДФН. Такая реакция обычно начинается с НАД + либо из пути de-novo, либо из пути восстановления, когда НАД + киназа добавляет дополнительную фосфатную группу. НАД (Ф) + нуклеозидаза позволяет синтезировать никотинамид в пути спасения, а НАДФ + фосфатаза может конвертировать НАДФН обратно в НАДН для поддержания баланса. Некоторые формы НАД + киназы, особенно в митохондриях, также могут принимать НАДН, чтобы напрямую превращать его в НАДФН. Прокариотический путь менее изучен, но со всеми похожими белками процесс должен работать аналогичным образом.
НАДФН
НАДФН производится из НАДФ + . Основным источником NADPH в животных и других не-фотосинтезирующих организмов является пентозофосфатный путь , с помощью глюкозо-6-фосфатдегидрогеназы (G6PDH) на первой стадии. Пентозофосфатный путь также производит пентозу, другую важную часть НАД (Ф) Н, из глюкозы. Некоторые бактерии также используют G6PDH для пути Entner – Doudoroff , но продукция NADPH остается прежней.
Ферредоксин-НАДФ + редуктаза , присутствующая во всех сферах жизни, является основным источником НАДФН в фотосинтезирующих организмах, включая растения и цианобактерии. Оказывается , что в последней стадии цепочки электронов из световых реакций в процессе фотосинтеза . Он используется в качестве восстанавливающей силы для биосинтетических реакций в цикле Кальвина, чтобы ассимилировать углекислый газ и помочь превратить углекислый газ в глюкозу. Он также выполняет функции приема электронов в других нефотосинтетических путях: он необходим для восстановления нитратов до аммиака для усвоения растениями в азотном цикле и для производства масел.
Есть несколько других менее известных механизмов генерации НАДФН, все из которых зависят от присутствия митохондрий у эукариот. Ключевыми ферментами в этих процессах, связанных с углеродным метаболизмом, являются изоформы яблочного фермента , связанные с НАДФ , изоцитратдегидрогеназа (IDH) и глутаматдегидрогеназа . В этих реакциях НАДФ + действует как НАД + в других ферментах в качестве окислителя. Механизм изоцитратдегидрогеназы, по-видимому, является основным источником НАДФН в жире и, возможно, также в клетках печени. Эти процессы также обнаруживаются у бактерий. Бактерии также могут использовать НАДФ-зависимую глицеральдегид-3-фосфатдегидрогеназу с той же целью. Как и пентозофосфатный путь, эти пути связаны с частями гликолиза .
НАДФН также может вырабатываться путями, не связанными с углеродным метаболизмом. Ферредоксинредуктаза является таким примером. Никотинамиднуклеотидтрансгидрогеназа переносит водород между НАД (Ф) Н и НАД (Ф) + и обнаруживается в митохондриях эукариот и многих бактерий. Есть версии, которые зависят от протонного градиента для работы, и те, которые не работают. Некоторые анаэробные организмы используют NADP + -связанную гидрогеназу , отрывая гидрид от газообразного водорода с образованием протона и NADPH.
Как и НАДН , НАДФН флуоресцентный . НАДФН в водном растворе, возбужденный при поглощении никотинамида ~ 335 нм (около УФ), имеет флуоресцентное излучение с пиком при 445-460 нм (от фиолетового до синего). НАДФ + не имеет заметной флуоресценции.
Что такое НАДХ
NADH относится к восстановленной форме NAD +, которая продуцируется в цикле гликолиза и Кребса. При гликолизе две молекулы NADH продуцируются на молекулу глюкозы. Шесть молекул NADH образуются в цикле Кребса на молекулу глюкозы. Эти молекулы NADH используются в цепи переноса электронов для получения молекул АТФ. Производство NADH в гликолизе и цикле Кребса и использование NADH в цепи переноса электронов показано в фигура 2.
Рисунок 2: Клеточное дыхание
Белки, внедренные во внутреннюю мембрану митохондрий, получают электроны из молекул NADH. Эти электроны транспортируются через различные белковые молекулы цепи переноса электронов. В конечном счете, они получены молекулами кислорода с образованием воды. Это означает, что молекулы кислорода являются конечными акцепторами электронов в аэробном дыхании. Энергия, выделяемая в процессе, используется для производства АТФ путем окислительного фосфорилирования. В процессе ферментации другие молекулы служат в качестве конечных акцепторов электронов, поскольку в среде отсутствует кислород. Регенерация НАД+ происходит через фосфорилирование на уровне субстрата.
Что такое НАДП +
НАДФ+ является окисленной формой NADP (никотинамидадениндинуклеотидфосфат), которая является коферментом, участвующим в анаболических реакциях, подобных NAD+, перенося электроны. NADPH — это сокращенное состояние NADP. Примечательно, что структурные компоненты NADP такие же, как NAD. Однако основным структурным различием между NADP и NAD является наличие дополнительной фосфатной группы в NADP на 2′-углероде рибозного кольца, которая связывается с адениновым фрагментом.

Рисунок 2: НАДФ+
Кроме того, НАДП+ также принимает атом водорода или, другими словами, пару электронов, во время окислительно-восстановительных реакций. Основные типы анаболических реакций, которые использует НАДФ+ В качестве окислителя используются цикл Кальвина, темновая реакция фотосинтеза. NADPH синтезируется световой реакцией фотосинтеза, и его способность к восстановлению используется в темновой реакции для ассимиляции углекислого газа. Кроме того, НАДФ участвует в пентозофосфатном пути у животных в качестве кофермента.
Обмен витамина РР в организме
Судьба никотиновой кислоты, поступающей в организм, зависит от вида питания и содержащихся в нем продуктов. Как уже упоминалось выше, никотиновая кислота, находящаяся в ряде зерновых продуктов в форме сложного эфира — ниацитина, на 95—96% не усваивается организмом человека, собаки и крысы, тогда как ниацин, находящийся в животных и бобовых продуктах, усваивается ими целиком.
Организм человека, собаки и свиньи не в состоянии синтезировать никотиновую кислоту в количествах, необходимых для покрытия потребности в ней организма, и поэтому постоянно нуждается в получении ее с пищей. Некоторые млекопитающие, например крыса, лошадь, корова и овца, могут синтезировать никотиновую кислоту.
Источником никотиновой кислоты является триптофан. Начиная с 1945 г. в ряде работ описаны отдельные этапы синтеза никотиновой кислоты из триптофана у млекопитающих.Существуют два пути эндогенного синтеза ниацина в организме животных: микробный синтез в кишечнике и биосинтез в тканях. Основное превращение L-триптофана идет по пути расщепления триптофан-пирролазой его пиррольного кольца с образованием формил-кинуренина, из которого образуются кинуренин и 3-оксикинуренин, являющиеся одними из главных продуктов диссимиляции триптофана в организме. 3-оксикинуренин далее превращается в 3-оксиантраниловую кислоту. После включения двух атомов кислорода образуются 2-акролеил-З-аминофумаровая кислота и хинолиновая кислота, являющаяся предшественником никотиновой кислоты. В результате ряда промежуточных реакций у всеядных животных и человека образуются никотиновая кислота и Nl-метилникотинамид.
При сбалансированном питании лишь незначительная часть триптофана выделяется из организма животных и человека с мочой в виде специфических продуктов его распада. При нагрузках триптофаном с мочой выделяются в значительных количествах такие продукты его обмена, как кинуренин, 3-оксикинуренин, кинуреновая и ксантуреновая кислоты. Участие витамина B6 в обмене триптофана у млекопитающих предполагалось в связи с обнаружением в моче при недостаточности витамина B6 ксантуреновой кислоты — одного из продуктов обмена триптофана. Кроме того, ряд авторов наблюдали при недостаточности витамина B6 у животных снижение концентрации НАД и НАДФ в эритроцитах крови и снижение выделения Nl-метилникотинамида с мочой.
Оказалось, что производное витамина В6 — пиридоксальфосфат является ко-ферментом кинурениназы, участвующим в гидролитическом расщеплении кинуренина и 3-оксикинуренина. Нарушение кинурениназной реакции при недостаточности витамина В6 приводит к нарушению синтеза 3-оксиантраниловой кислоты и снижению образования никотиновой кислоты.
Никотиновая кислота, поступающая в организм человека и всеядных и плотоядных животных, переходит в никотинамид и затем метилируется в Nl-метилникотинамид, который частично окисляется в Nl-метил-2-пиридон-5-карбоксамид. От 40 до 50% принятой никотиновой кислоты выделяется в этой форме. У травоядных животных никотиновая кислота не переходит в амид и выделяется с мочой в свободном или связанном виде, а находящийся в пище этих животных никотинамид выделяется в виде никотиновой или никотинуровой кислот. Метилирование никотинамида происходит путем присоединения метильной группы к азоту пиридинового кольца. Nl-метилникотинамид имеет адсорбционный максимум в ультрафиолетовых лучах 264,5 нм. Nl-метилникотинамид 6-пиридон — 260 и 290 нм.
Подсчет выделения с мочой метаболитов никотиновой кислоты у людей, получавших различные количества витамина РР и триптофана, показал, что в среднем от 55 до 60 мг триптофана, содержащегося в пище, эквивалентны 1 мг никотиновой кислоты.
Horwitt предложил называть 1 мг никотиновой кислоты, или 60 мг трип-тофана «ниациновым эквивалентом». Таким образом, в никотиновую кислоту превращается от 1,9 до 5% (в среднем 3,3%) триптофана.
Health Benefits of NADPH and NADPH Oxidase
1) Increases Antioxidants
NADPH increases the antioxidant status of the body. It provides the electrons necessary for biological reactions that involve reduction (the opposite of oxidation) and protects the tissues against oxidative stress and cell death .
The production of glutathione (GSH), an important antioxidant, requires NADPH. Some scientists think that NADPH plays a bigger role in antioxidant defense in red blood cells than GSH [].
NADPH also plays important roles in the function of two other antioxidant systems: thioredoxin and catalase .
2) Helps Prevent Anemia
NADPH is essential in protecting against oxidative stress in red blood cells (erythrocytes), which transport oxygen and carbon dioxide to and from the tissues [].
A lack of NADPH can cause hemolysis or the rupturing of red blood cells due to oxidative damage of the cell membrane. The lack of viable red blood cells causes anemia [].
Glucose-6-phosphate dehydrogenase () is needed to convert NADP+ into NADPH. In people with genetic G6PD deficiency, NADPH production is insufficient. This makes red blood cells more susceptible to reactive oxygen species, ultimately causing anemia, spontaneous abortions, and problems with fetuses [].
3) Protects the Immune System
By generating free radicals in immune cells, NADPH oxidase helps destroy pathogens through a respiratory burst. In this process, neutrophils (a type of white blood cell) rapidly transform oxygen into reactive oxygen species [].
NOX plays an important role in antimicrobial defense. Microbes and microbial-derived products activate NOX, which then assembles quickly and makes reactive oxidant intermediates (ROIs) to defend the organism against the infectious threat [].
Neutrophils require NOX to protect the body from infectious microbes such as the fungus Aspergillus fumigatus and the bacteria Burkholderia cepacia, both of which can cause infections in people with a weakened immune system [].
In other immune cells (macrophages and dendritic cells), NOX2’s roles are less clear. However, scientists believe that NOX2 helps limit chronic inflammation [].
The effects of NOX activation on inflammation depends on the person and can either reduce or aggravate inflammation. Without NOX, excessive inflammation can cause frequent and harsh bacterial and fungal infections [].
Функция [ править ]
НАДФН обеспечивает восстановительные эквиваленты для биосинтетических реакций и окислительно-восстановительных реакций, участвующих в защите от токсичности активных форм кислорода (АФК), обеспечивая регенерацию глутатиона (GSH). НАДФН также используется в анаболических путях, таких как синтез холестерина, синтез стероидов, синтез аскорбиновой кислоты, синтез ксилита, синтез цитозольных жирных кислот и удлинение цепи микросомальных жирных кислот .
Система НАДФН также отвечает за образование свободных радикалов в иммунных клетках с помощью НАДФН-оксидазы . Эти радикалы используются для уничтожения патогенов в процессе, называемом респираторным взрывом .
Она является источником восстановительных эквивалентов для цитохрома P450 гидроксилирования из ароматических соединений , стероидов , спиртов и наркотиков .
Разница между NAD + и NADP +
Определение
NAD+ относится к коферменту, который встречается во многих живых клетках и функционирует как акцептор электронов, в то время как НАДФ+ относится к коферменту, который функционирует как универсальный носитель электронов, принимая электроны и атомы водорода с образованием НАДФН или никотинамидадениндинуклеотидфосфата. Таким образом, в этом главное отличие NAD + от NADP +.
Структурная разница
Также НАД+ не содержит каких-либо дополнительных фосфатных групп на рибозных кольцах, но НАДФ+ содержит фосфатную группу на 2′-углероде рибозного кольца, которое несет адениновый фрагмент.
Сокращенное состояние
Более того, их уменьшенное состояние является еще одной разницей между NAD + и NADP +. NADH — это сокращенное состояние NAD+ в то время как НАДФН является сокращенным состоянием НАДФ+.
функция
Кроме того, НАД+ служит коферментом в клеточном дыхании, в то время как НАДФ+ служит коферментом в фотосинтезе. Следовательно, это еще одно различие между NAD + и NADP +.
Сотовая Судьба
NAD+ восстанавливается до NADH как в гликолизе, так и в цикле TCA, а восстанавливающая способность NADH используется для генерации АТФ в цепи переноса электронов. Но НАДП+ уменьшается в свете реакции фотосинтеза и восстанавливающая способность NADPH используется для ассимиляции углекислого газа в темноте реакции. Итак, это еще одно различие между NAD+ и НАДП+.
Заключение
NAD+ является окислителем, используемым в качестве кофермента при катаболических реакциях в клетке, включая клеточное дыхание. NAD — сокращенная форма NAD+, Для сравнения, НАДП+ является другим коферментом, который служит окислителем в анаболических реакциях, включая фотосинтез. Его сокращенная форма — НАДП. Оба NAD+ и НАДП+ адениновые нуклеотиды, участвующие в переносе электронов между окислительно-восстановительными реакциями. Тем не менее, основное различие между NAD + и NADP + заключается в типе клеточного метаболизма.
Сходства между NAD + и NADP +
- NAD+ и НАДП+ два кофермента, участвующих в клеточном метаболизме.
- Оба находятся в своем окисленном состоянии. Следовательно, они могут получать электроны, выделяющиеся в результате реакций окисления, служа окислителем.
- Кроме того, оба могут существовать в их восстановленной форме, которая высвобождает электроны для восстановления продукта, служа восстановителем.
- Более того, они являются формой никотинамид-адениновых нуклеотидов. Также они содержат два рибозных кольца.
- Кроме того, оба изобилуют внутри клетки, передавая электроны между химическими реакциями.
- В дополнение к метаболической функции, как NADH, так и NADPH выполняют важные физиологические функции, включая экспрессию генов, митохондриальные функции, регуляцию кальция, антиокисление и генерацию окислительного стресса, иммунных функций, процесса старения и гибели клеток.
Что такое НАД +
NAD+ является окисленной формой NAD (никотинамид-аденин-динуклеотид), который является коферментом, участвующим в катаболических реакциях в качестве носителя электронов. NADH — это сокращенное состояние NAD. Как правило, НАД имеет две фосфатные группы, связанные молекулой кислорода. Кроме того, каждая фосфатная группа связывается с пятиуглеродным рибозным сахаром. Кроме того, один рибозный сахар связывается с адениннуклеотидом, в то время как второй рибозный сахар связывается с никотинамидным фрагментом. Особенно переход NAD в NAD+ происходит в молекуле азота никотинамидной части.

Рисунок 1: NAD+ и НАД
Кроме того, основная функция NAD+ это принять атом водорода или, другими словами, протон. Здесь принятие протона означает принятие пары электронов. Поэтому НАД+ участвует в окислительно-восстановительных реакциях клеточного дыхания, включая гликолиз, цикл ТСА и цепь переноса электронов. Кроме того, и гликолиз, и цикл TCA производят NADH, энергия восстановления которого используется в цепи переноса электронов для генерации ATP. Кроме того, НАД служит коферментом в реакциях синтеза жирных кислот и синтеза стеролов.
Что такое НАДХ
НАДН относится к сокращенной форме НАД. НАД является одним из наиболее распространенных типов кофермента внутри клетки, участвуя в окислительно-восстановительных реакциях клеточного дыхания. В основном используется при катаболических реакциях. НАДН производится в гликолизе и цикле Кребса. Большинство дегидрогеназ используют NAD+ в качестве кофермента, отдавая водород и электроны для производства NADH. NAD+ является окисленной формой НАД. Два NADH производятся в гликолизе, в то время как шесть NADH производятся в цикле Кребса. FADH2 также производится в цикле Кребса. Это также служит другим коферментом как NADH. И NADH, и FADH2 используются в цепи переноса электронов. Электронная транспортная цепь показана на Рисунок 1.

Рисунок 1: Электронная транспортная цепь
Поскольку NADH служит донором электронов и водорода, он жертвует свои электроны мембранным белкам внутренней митохондриальной мембраны. Эти электроны используются в производстве АТФ посредством окислительного фосфорилирования.
Функция
НАДФН обеспечивает восстановительные эквиваленты для биосинтетических реакций и окислительно-восстановительных реакций, участвующих в защите от токсичности активных форм кислорода (АФК), обеспечивая регенерацию глутатиона (GSH). НАДФН также используется для анаболических путей, таких как синтез холестерина, синтез стероидов, синтез аскорбиновой кислоты, синтез ксилита, синтез цитозольных жирных кислот и удлинение цепи микросомальных жирных кислот .
Система НАДФН также отвечает за образование свободных радикалов в иммунных клетках с помощью НАДФН-оксидазы . Эти радикалы используются для уничтожения патогенов в процессе, называемом респираторным взрывом . Это источник восстановительных эквивалентов для цитохрома P450 гидроксилирования из ароматических соединений , стероидов , спиртов и наркотиков .
Сотовая роль
На метаболическом уровне НАДФН в основном продуцируется окислительной фазой пентозофосфатного пути . НАДФН является основным источником электронов, используемых в биосинтетических реакциях в клетке. Он также используется в защитных механизмах против окислительного стресса и активных форм кислорода (АФК). Детоксикация этих реактивных видов включает глутатион, который должен постоянно регенерироваться глутатионредуктазой по следующей схеме:
- GSSG + NADPH + H + 2 GSH + NADP + .
Заболевание обмена веществ, известное как фавизм или дефицит глюкозо-6-фосфатдегидрогеназы (G6PDH), приводит к клеточному дефициту НАДФН. Это происходит из-за дефицита G6PDH, который катализирует первую стадию окислительной фазы пентозофосфатного пути . Это приводит, в частности, к повышенной чувствительности к окислительному стрессу .
Что такое НАДФН?
НАДФН означает никотинамид-аденин-динуклеотид-фосфат. Как следует из названия, помимо химического состава НАДН в НАДФН есть дополнительная фосфатная группа. Это кофермент, который действует как восстанавливающий агент в большинстве реакций, в основном в анаболических реакциях. Кроме того, он играет важную роль в метаболизме липидов и метаболизме нуклеиновых кислот.
Синтез или выработка НАДФН в основном происходит через пентозофосфатный путь. Кроме того, НАДФН синтезируется посредством ферментативной реакции, в которой используется НАДН-киназа. В митохондриях киназа НАДН превращает НАДН в НАДФН. У растений образование НАДФН происходит в ходе световых реакций фотосинтеза.
В чем разница между НАД и НАДФ?
НАД и НАДФ — относительные коферменты. НАД — кофермент живых клеток, который участвует в основном в окислительно-восстановительных реакциях клеточного дыхания. С другой стороны, НАДФ — еще один важный кофермент, который преимущественно участвует в окислительно-восстановительных реакциях анаболического метаболизма. Итак, это ключевое различие между НАД и НАДФ.
Более того, НАДФ имеет дополнительную фосфатную группу, тогда как эта дополнительная фосфатная группа отсутствует в молекуле НАД. Таким образом, это также существенная разница между НАД и НАДФ. Кроме того, производство НАД происходит либо путем «de novo» из аминокислот, либо путем рециркуляции никотинамида обратно в НАД. С другой стороны, биосинтез НАДФ требует фосфорилирования НАД, катализируемого киназой НАД. Следовательно, мы можем рассматривать это как еще одно различие между НАД и НАДФ.
Инфографика ниже содержит дополнительную информацию о различиях между NAD и NADP.

What is NADP+
NADP+ is the oxidized form of NADP (nicotinamide adenine dinucleotide phosphate), which is a coenzyme involved in anabolic reactions similar to NAD+, transferring electrons. is the reduced state of NADP. Significantly, the structural components of NADP are the same as NAD. However, the main structural difference between NADP and NAD is the presence of an additional phosphate group in the NADP on the 2′ carbon of the ribose ring, which links to the adenine moiety.
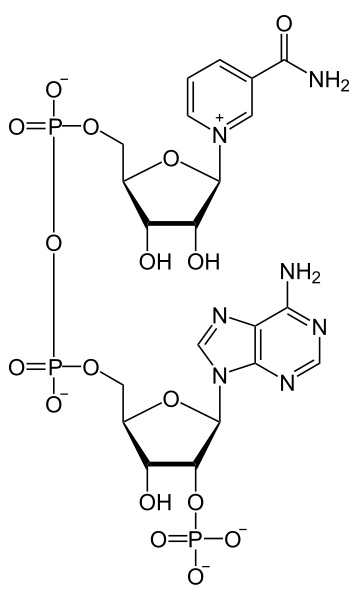
Figure 2: NADP+
Moreover, NADP+ also accepts a hydrogen atom or in other words, a pair of electrons, during redox reactions. The main types of anabolic reaction which uses NADP+ as an oxidizing agent are the Calvin cycle, the dark reaction of photosynthesis. NADPH is synthesized by the light reaction of photosynthesis and its reduction power is used in the dark reaction in order to assimilate carbon dioxide. In addition, NADP is involved in the pentose phosphate pathway in animals as a coenzyme.
Функция [ править ]
НАДФН обеспечивает восстановительные эквиваленты для биосинтетических реакций и окислительно-восстановительных реакций, участвующих в защите от токсичности активных форм кислорода (АФК), обеспечивая регенерацию глутатиона (GSH). НАДФН также используется для анаболических путей, таких как синтез холестерина, синтез стероидов, синтез аскорбиновой кислоты, синтез ксилита, синтез цитозольных жирных кислот и удлинение цепи микросомальных жирных кислот .
Система НАДФН также отвечает за образование свободных радикалов в иммунных клетках с помощью НАДФН-оксидазы . Эти радикалы используются для уничтожения патогенов в процессе, называемом респираторным взрывом .
Это источник восстановительных эквивалентов для цитохрома P450 гидроксилирования из ароматических соединений , стероидов , спиртов и наркотиков .
Главное отличие — НАД против НАДП
NAD и NADP — два типа коферментов, используемых в клеточном метаболизме. Оба соединения используются для переноса электронов из одной реакции в другую. Таким образом, и НАД, и НАДФ содержат окисленную и восстановленную форму. Восстановленная форма NAD представляет собой NADH, в то время как окисленная форма представляет собой NAD+, В НАДФ восстановленной формой является НАДН, а окисленной формой является НАДФ+, главное отличие между NAD и NADP является то, что NAD используется в клеточном дыхании, тогда как NADP используется в фотосинтезе.
Ключевые области покрыты
1. Что такое НАД — определение, особенности, функции2. Что такое НАДП — определение, особенности, функции3. Каковы сходства между НАД и НАДП — Краткое описание общих черт4. В чем разница между НАД и НАДП — Сравнение основных различий
Ключевые слова: клеточное дыхание, коэнзим, NAD, NAD+, НАДФ, НАДФН, фотосинтез







