Бескислородное окисление глюкозы включает два этапа
Содержание:
- Регуляция общего пути катаболизма
- Классификация анаэробов
- Путь[править]
- В сочетании с восстановлением нитратов и нитритов [ править ]
- Анаэробное окисление: брожение и гниение
- Эффект Пастера
- Пентозофосфатный путь (ПФП)
- Обходной путь 1. Образование фосфоенолпирувата
- Взаимосвязь гликолиза и аэробных реакций [ править
- В сочетании с сульфатредукцией
- Физиологическое значение
- Получение глюкозы
- В сочетании с восстановлением нитратов и нитритов
- Степень аэробности среды
- Бескислородное окисление глюкозы включает два этапа
Регуляция общего пути катаболизма
Осталось поговорить про регуляцию работы пируватдегидрогеназного комплекса и ЦТК. Основная задача для регуляции — поддерживать энергетическое соотношение в клетке. Если в клетке достаточно АТФ, то общий путь катаболизма должен быть отключён. Если концентрация АТФ падает, а нарастает АДФ или АМФ, то нужно запускать общий путь катаболизма.
Основной механизм регуляции пируватдегидрогеназного комплекса и ЦТК — . Она достаточно быстро и чутко реагирует на изменения энергетического соотношения в клетке. Удивительно, что гормональной регуляции с помощью фосфорилирования/дефосфорилирования здесь нет.
Организм отдал регуляцию общего пути катаболизма на усмотрение клетки. Гликолиз и такого доверия не заслужили. С другой стороны, зачем регулировать каждый этап катаболизма гормонально? Достаточно установить контроль над специфическими путями катаболизма, но я отвлёкся.
Регуляция окислительного декарбоксилирования пирувата
Пируватдегидрогеназный комплекс состоит не только из трёх ферментов и пяти коферментов. С первым ферментом (пируватдегидрогеназой) связаны ещё две белковые субъединицы: киназа и фосфатаза. Киназа фосфорилирует пируватдегидрогеназу по -OH группе — переводит её в неактивную форму. Такое случается при избытке АТФ внутри митохондрии. Отдыхаем после тяжёлого дня, лёжа на диване. Фосфатаза же увеличивает свою работоспособность при снижении концентрации АТФ внутри клетки. Это приводит к дефосфорилированию пируватдегидрогеназы — активация фермента. Бежим за маршруткой — нужна энергия.
Киназа и фосфатаза пируватдегидрогеназного комплекса
Это фофорилирование/дефосфорилирование, но не гормональное. Оно подкрепляет аллостерическую регуляцию. Киназа запускается при избытке АТФ, а фосфатаза при его дефиците. Но давайте перейдём к аллостерической регуляции.
Пируватдегидрогеназный комплекс аллостерически ингибируется: АТФ, НАДH, жирными кислотами, ацетил-коэнзимом А.
ПДК ингибируется: АТФ, НАДH, жирными кислотами и ацетил-коэнзимом А
Все эти продукты накапливаются, когда клетке не нужна энергия. Понятно дело, что нужно остановить общий путь катаболизма, если в клетке куча АТФ и субстратов для её синтеза.
Пируватдегидрогеназный комплекс аллостерически активируется: АДФ, НАД+, коэнзимом А, кальцием.
ПДК активируется: АДФ, НАД+, коэнзимом А и кальцием
С первыми тремя всё ясно — они накапливаются, когда клетке нужна энергия, а её не хватает. Нужно ускорить работу пируватдегидрогеназного комплекса — образовать больше ацетил-коэнзима А. Чем больше ацетил-коэнзима А, тем больше энергии будет получено в ходе ЦТК. А что с кальцием? Кальций работает в мышцах и сердце. При сокращениях небольшая часть кальция попадает в митохондрию. Это стимулирует активность пируватдегидрогеназного комплекса и других ферментов ЦТК — об этом ниже.
Регуляция цикла Кребса
Идёт по трём необратимым реакциям: первой, третьей и четвёртой. Регулируются два фермента и один комплекс: цитратсинтаза, изоцитратдегидрогеназа и альфа-кетоглутаратдегидрогеназный комплекс.
Цитратсинтаза. Аллостерически ингибируется: АТФ, НАДH, цитратом и сукцинил-коэнзимом А. Активируется: АДФ.
Изоцитратдегидрогеназа. Ингибируется: АТФ. Активируется: АДФ и кальцием.
Альфа-кетоглутаратдегидрогеназный комплекс. Ингибируется: НАДH и сукцинил-коэнзим А. Активируется: кальцием.
Регуляция ЦТК по первой, третьей и четвертой реакции.
Видно, что наибольшее количество аллостерических регуляторов у цитратсинтазы и пируватдегидрогеназного комплекса. Это неудивительно, две эти реакции отвечают за старт цикла. Цитратсинтаза ингибируется не только продуктом своей реакции, но и продуктом четвертой реакции — сукцинил-коэнзимом А.
Хочешь задать вопрос, похвалить или наговорить гадостей? Тогда залетай в телегу. Там ты сможешь предложить новый формат или разбор темы. А если серьёзно, то эти статьи пишутся для вас, поэтому мне важна обратная связь.
Классификация анаэробов
Различают два основных типов анаэробов:
- Факультативы (кишечная палочка, стафилококк, стрептококк, шигелл). Приспособлены к существованию как в кислородной, так кислородсодержащей среде).
- Облигатные существуют исключительно в бескислородной среде. Малейший контакт с этим газом приводит к гибели этих организмов.
Облигатные микроорганизмы также делятся на две категории:
- Клостридии – возбудители развития ряда инфекций, в частности бутулизма, столбняка. Образуют споры.
- Неклостридиальные – не представляющие опасности как для человека, так и других живых существ. Это – бактериоды, эубактерии, пейллонеллы, пептококки. Не образуют споры.
В жидкой питательной среде факультативы равномерно распределены по всем ее слоям, облигатные же, избегая контакта с кислородом, сосредоточены в нижних.
Путь[править]
Первой реакцией гликолиза является фосфорилирование молекулы глюкозы, происходящее при участии тканеспецефичного фермента гексокиназы с затратой энергии 1 молекулы АТФ; образуется активная форма глюкозы — глюкозо-6-фосфат (Г-6-Ф):
Для протекания реакции необходимо наличие в среде ионов Mg2+, с которым комплексно связывается молекула АТФ. Эта реакция необратима и является первой ключевой реакцией гликолиза.
Фосфорилирование глюкозы преследует две цели: во-первых, из-за того что плазматическая мембрана, проницаемая для нейтральной молекулы глюкозы, не пропускает отрицательно заряженные молекулы Г-6-Ф, фосфорилированная глюкоза оказывается запертой внутри клетки. Во-вторых, при фосфорилировании глюкоза переводится в активную форму, способную участвовать в биохимических реакциях и включаться в метаболические циклы. Фосфорилирование глюкозы — это единственная реакция в организме, в которой глюкоза участвует как таковая.
Печёночный изофермент гексокиназы — глюкокиназа — имеет важное значение в регуляции уровня глюкозы в крови.
В следующей реакции (2) ферментом фосфоглюкоизомеразой Г-6-Ф превращается во фруктозо-6-фосфат (Ф-6-Ф):
Энергия для этой реакции не требуется, и реакция является полностью обратимой. На данном этапе в процесс гликолиза может также включаться путём фосфорилирования и фруктоза.
Далее почти сразу друг за другом следуют две реакции: необратимое фосфорилирование фруктозо-6-фосфата (3) и обратимое альдольное расщепление образовавшегося фруктозо-1,6-бифосфата (Ф-1,6-бФ) на две триозы (4).
Фосфорилирование Ф-6-Ф осуществляется фосфофруктокиназой с затратой энергии ещё одной молекулы АТФ; это вторая ключевая реакция гликолиза, её регуляция определяет интенсивность гликолиза в целом.
Альдольное расщепление Ф-1,6-бФ происходит под действием альдолазы фруктозо-1,6-бифосфата:
В результате четвёртой реакции образуются дигидроксиацетонфосфат и глицеральдегид-3-фосфат, причём первый почти сразу под действием фосфотриозоизомеразы переходит во второй (5), который и участвует в дальнейших превращениях:
Каждая молекула глицеральдегидфосфата окисляется НАД+ в присутствии дегидрогеназы глицеральдегидфосфата до 1,3-дифосфоглицерата (6):
Далее с 1,3-дифосфоглицерата, содержащего макроэргическую связь в 1 положении, ферментом фосфоглицераткиназой на молекулу АДФ переносится остаток фосфорной кислоты (реакция 7) — образуется молекула АТФ:
Это первая реакция субстратного фосфорилирования. С этого момента процесс расщепления глюкозы перестаёт быть убыточным в энергетическом плане, так как энергетические затраты первого этапа оказываются компенсированными: синтезируются 2 молекулы АТФ (по одной на каждый 1,3-дифосфоглицерат) вместо двух потраченных в реакциях 1 и 3. Для протекания данной реакции требуется присутствие в цитозоле АДФ, то есть при избытке в клетке АТФ (и недостатке АДФ) её скорость снижается. Поскольку АТФ, не подвергающийся метаболизму, в клетке не депонируется а просто разрушается, то эта реакция является важным регулятором гликолиза.
Затем последовательно: фосфоглицеролмутаза образует 2-фосфоглицерат (8):
Енолаза образует фосфоенолпируват (9):
И наконец происходит вторая реакция субстратного фосфорилирования АДФ с образованием енольной формы пирувата и АТФ (10):
Реакция протекает под действием пируваткиназы. Это последняя ключевая реакция гликолиза. Изомеризация енольной формы пирувата в пируват происходит неферментативно.
С момента образования Ф-1,6-бФ с выделением энергии протекают только реакции 7 и 10, в которых и происходит к субстратное фосфорилировнаие АДФ.
В сочетании с восстановлением нитратов и нитритов [ править ]
Общие реакции следующие:
- CH 4 + 4NO 3 — → CO 2 + 4NO 2 — + 2H 2 O
- 3CH 4 + 8NO 2 — + 8H + → 3CO 2 + 4N 2 + 10H 2 O
Недавно было показано, что ANME-2d отвечает за АОМ, управляемый нитратами. ANME-2d, названный Methanoperedens nitroreducens , способен выполнять АОМ, управляемый нитратами, без организма-партнера посредством обратного метаногенеза с нитратом в качестве концевого акцептора электронов, используя гены восстановления нитрата, которые были латерально переданы от бактериального донора. Это также был первый полный путь обратного метаногенеза, включающий гены mcr и mer .
В 2010 году омикс-анализ показал, что восстановление нитрита может быть связано с окислением метана одним бактериальным видом Candidatus Methylomirabilis oxyfera ( тип NC10 ) без необходимости в архейном партнере.
Анаэробное окисление: брожение и гниение
Брожение представляет анаэробный процесс, в ходе которого происходит превращение органических веществ, не содержащих азот в более простые соединения посредством включения микроорганизмов. При этом осуществляется выделение энергии и накопление продуктов неполного окисления. Главная функция брожения – образование энергии, поддерживающей процессы жизнеобеспечения внутри микроорганизмов.
Также как брожение, гниение представляет собой процесс разложения органических веществ. Однако в отличие от брожения, гниение осуществляется под воздействием аммонификаторов и сопровождается выделением газообразного аммиака. Процесс происходит главным образом в белковых соединениях, содержащих азот.
Эффект Пастера
Эффект Пастера — это снижение потребления глюкозы и прекращение продукции молочной кислоты клеткой в присутствии кислорода. Биохимическая основа эффекта заключается в конкуренции за субстрат между пируватдегидрогеназой, превращающей пируват в ацетил-S-КоА, и , превращающей пируват в лактат.
У пируватдегидрогеназы сродство гораздо выше и в обычных аэробных условиях она окисляет большую часть пировиноградной кислоты. Как только поступление кислорода уменьшается (анемии, нарушение кровообращения, спазм сосудов, тромбозы и т.п.) происходит следующее:
- внутримитохондриальные процессы дыхания не идут и НАДН в дыхательной цепи не окисляется,
- моментально накапливающийся в митохондриях НАДН тормозит цикл трикарбоновых кислот,
- ацетил-S-КоА не входит в ЦТК и вместе с НАДН ингибирует ПВК-дегидрогеназу.
В этой ситуации пировиноградной кислоте не остается ничего иного как превращаться в молочную.
При наличии кислорода ингибирование ПВК-дегидрогеназы прекращается и она, обладая большим сродством к пирувату, выигрывает конкуренцию.
Отличной иллюстрацией к сказанному служит чувствительность миокарда и нейронов к недостатку кислорода:
Роль лактатдегидрогеназы в клетке
В норме работу клеток нервной системы и миокарда при аэробных условиях обеспечивает большое количество митохондрий и поступление из крови субстратов для окисления – глюкозы, кетоновых тел, жирных кислот (только для миокарда), лактата, превращегося в пируват.
В основе высокой чувствительности этих органов к отсутствию кислорода лежит изоферментов лактатдегидрогеназы друг от друга. Рассмотрим это на прмиере ЛДГ-1 и ЛДГ-5.
Сердечный изофермент ЛДГ-1, обладая высоким сродством к молочной кислоте, переводит ее в пировиноградную, «стремясь» поднять концентрацию пирувата с целью его включения в цикл трикарбоновых кислот (только в аэробных условиях) и получения энергии для сокращения миокардиоцита. Поэтому миокард не образует лактат, но зато может использовать его для получения энергии, захватывая из крови, но только в аэробных условиях. Аналогично лактат используется нервной системой.
При нехватке кислорода свойства изофермента ЛДГ-1 не изменятся, он по-прежнему будет сдвигать реакцию в сторону продукции пировиноградной кислоты (на схеме «справа-налево»). Однако без кислорода «сгореть» в ЦТК пируват не может и выйти из клетки тоже не может, т.к. клеточные мембраны непроницаемы для него. Являясь кислотой, он закисляет цитозоль, изменяя активность ферментов и, возможно, как-то еще проявляет токсичность. Таким образом, происходят необратимые повреждения кардиомиоцита и нейрона – развивается инфаркт миокарда. или ишемический инсульт.
В тоже время изофермент скелетной мышцы ЛДГ-5 обладает высоким сродством к пирувату, при отсутствии кислорода в клетке быстро и эффективно превращает его в молочную кислоту, обратная же реакция практически не идет. Закисление саркоплазмы снижает работоспособность миоцита. Мышца, хоть и не в состоянии работать в таких условиях, все-таки сохраняет жизнеспособность. Причина в том, что в клетке молочная кислота не накапливается – при помощи монокарбоксилатных переносчиков (monocarboxylate transporters – MCTs) она проходит через клеточные мембраны и относительно быстро удаляется из мышцы. После «отключки» скелетная мышца вновь становится работоспособной через несколько минут.
Таким образом, в анаэробных условиях сильнее всего будут страдать сердечная мышца и нервная система, что, собственно говоря, и наблюдается в медицинской практике.
Пентозофосфатный путь (ПФП)
Значение ПФП
Большая часть глюкозы расщепляется по гликолитическому пути. Наряду с гликолизом существуют второстепенные пути катаболизма глюкозы, одним из которых является пентозофосфатный путь (ПФП). Пентозофосфатный путь скорее даже — анаболический путь, который использует 6 атомов С глюкозы для синтеза пентоз и восстановительных эквивалентов в виде НАДФН, необходимых для образования липидов в организме. Однако, этот путь — окисление глюкозы, и при определенных условиях может завершиться полным окислением глюкозы до СО2 и Н2О. Главные функции этого цикла следующие:
Генерирование восстановительных эквивалентов в виде НАДФН для восстановительных реакций биосинтеза. Ферменты, которые катализируют реакции восстановления, часто используют в качестве кофактора НАДФ+/НАДФН, а окислительные ферменты — НАД+/НАДН. Восстановительные реакции биосинтеза жирных кислот и стероидных гормонов требуют НАДФН, поэтому клетки печени, жировой ткани и др., где протекает синтез липидов, имеют высокий уровень ферментов ПФП. В печени около 30% глюкозы подвергаются превращениямв ПФП.
НАДФН используется при обезвреживании лекарств и чужеродных веществ в монооксигеназной цепи окисления в печени.
НАДФН предохраняет ненасыщенные жирные кислоты эритроцитарной мембраны от аномальных взаимодействий с активным кислородом. Кроме того, эритроциты используют реакции ПФП для генерирования больших количеств НАДФН, который необходим для восстановления глутатиона, участвующего в системе обезвреживания активного кислорода, что позволяет поддерживать нормальную степень окисления Fe2+ в гемоглобине.
Снабжение клеток рибозо-5-фосфатом для синтеза нуклеотидов, нуклеотидных коферментов и нуклеиновых кислот. Превращение рибонуклеотидов в дезоксирибонуклеотиды также требует НАДФН, поэтому многие быстро пролиферирующие клетки требуют больших количеств НАДФН.
Хотя это не значительная функция ПФП, он принимает участие в метаболизме пищевых пентоз, входящих в состав нуклеиновых кислот пищи и может превращать их углеродный скелет в интермедиаты гликолиза и глюконеогенеза.
Реакции ПФП
Реакции ПФП протекают в цитоплазме. ПФП можно разделить на два этапа: окислительный и неокислительный. Субстратом является глюкозо-6-фосфат. Первая и третья реакции катализируются НАДФ-зависимыми дегидрогеназами. На этом этапе происходит окисление глюкозы с образованием 2 НАФН, поэтому реакции (1 — 3) — окислительная фаза ПФП. Фермент Е1 (глюкозо-6-фосфат-дегидрогеназа) — ключевой фермент ПФП, катализирует образование 6-глюконолактона. Лактон является неустойчивым соединением, которое легко гидролизуется спонтанно и под действием фермента Е2(специфической лактоназы). Фермент Е3 (6-фосфоглюконат-дегидрогеназа) катализирует реакцию окислительного декарбоксилирования.
Рибулозо-5-фосфат под действием ферментов рибозофосфатизомеразы и рибулозо-5-фосфат-3-эпимеразы может обратимо изомеризоваться в другие пентозы: рибозо-5-фосфат, ксилулозо-5-фосфат.
В некоторых тканях ПФП на этом заканчивается Суммарное уравнение ПФП:
глюкозо-6-фосфат + Н2О + НАДФ+ рибозо-5-фосфат + СО2 + НАДФН×Н+
Некоторые клетки нуждаются в большем количестве НАДФН, по сравнению с рибозо-5-фосфатом, т.е. НАФДН утилизируется, а рибозо-5-фосфат остается в избытке. В таких случаях рибозо-5-фосфат превращается в глицеральдегид-3-фосфат и фруктозо-6-фосфат (второй этап). Этот этап связывает ПФП с гликолизом.
Эти превращения катализируются двумя ферментами: транскетолазой (Е4)и трансальдолазой (Е5).
I
II
III
Фруктозо-6-фосфат и глицеральдегид-3-фосфат вступают на путь гликолиза.
Суммарное уравнение 2-го этапа:
рибозо-5-фосфат+2 ксилулоза-5-фосфат2 фруктозо-6-фосфат + глицеральдегид-3-фосфат
Обходной путь 1. Образование фосфоенолпирувата
Пируват, который образовался в ходе гликолиза был транспортирован в митохондрию. Нам повезло, потому что первый фермент обходного пути тоже находится в матриксе митохондрии. Этот фермент — митохондриальная пируваткарбокилаза.
Пируваткарбоксилаза присоединяет к пирувату CO2 — образуется оксалоацетат.
Первая реакция в образовании фосфоенолпирувата. Идёт в матриксе митохондрий.
Для этой реакции нужны молекула АТФ и кофермент — биотин. АТФ тратится на активацию бикарбонатного иона, так как у нас в организме большая часть CO2 растворена. Из бикарбонатного иона образуется CO2, который присоединяется к биотину. Биотин переносит CO2 на молекулу пирувата, клетка получает оксалоацетат.
Дальше нужно перенести оксалоацетат в цитоплазму клетки — там находятся семь ферментов, которые катализируют обратимые реакции гликолиза. Для оксалоацетата во внутренней мембране митохондрий нет переносчика. Но есть для малата. Поэтому сначала оксалоацетат превращается в малат. Катализатор — митохондриальная малатдегидрогеназа. Она присоединяет два протона и два электрона к молекуле оксалоацетата. Кофермент реакции — НАДH. Так образуется малат.
Образование малата в митохондрии
Митохондриальная малатдегидрогеназа обычно катализирует обратную реакцию — превращение малата в оксалоацетат. Так было в но почему здесь всё по-другому? Дело в том, что в митохондрии находится избыток НАДH, а не НАД+. Поэтому реакция идёт в другую сторону. Избыток НАДH обеспечивает окисление жирных кислот — запускается при голодании и/или физической нагрузке.
Далее малат транспортируется через внутреннюю мембрану с помощью белка-переносчика. В наружной мембране есть поры, поэтому дальше он влетает в цитоплазму.
Транспорт малата в цитоплазму
В цитоплазме клетки малат превращается в оксалоацетат с помощью цитоплазматической малатдегидрогеназы. При этом образуется оксалоацетат и НАДH. Эта реакция полезна, так как в шестой реакции для образования глицеральдегид-3-фосфата нужен НАДH. Так митохондрия передаёт избыток протонов и электронов на нужды цитоплазмы — всё это через образование малата.
Образование оксалоацетата в цитоплазме клетки
Теперь нужно превратить оксалоацетат в фосфоенолпируват. Для этого нужен второй фермент этого обходного пути — фосфоенолпируваткарбоксикиназа. Он получил название по обратной реакции. Кроме фермента, нужен источник энергии и фосфатной группы — здесь используется ГТФ. Образуется фосфоенолпируват, ГДФ и CO2. Так клетка обходит десятую реакцию гликолиза.
Вторая реакция обходного пути. Образование фосфоенолпирувата с помощью декарбоксилирования оксалоацетата
Пока что глюконеогенез дорогой процесс. Мы затратили молекулу АТФ и ГТФ на образование фосфоенолпирувата. А эта молекула содержит только три атома углерода. Для образования глюкозы нужно образовать два фосфоенолпирувата. То есть общие затраты энергии — 2 молекулы АТФ и 2 ГТФ.
Дальше идут обратимые реакции до образования фруктозо-1,6-бисфосфата (третья реакция гликолиза). В ходе седьмой реакции мы затратим ещё две молекулы АТФ на образование двух 1,3-бисфосфоглицератов.
Общие затраты энергии — 4 молекулы АТФ и 2 молекулы ГТФ. Дальше клетка не будет тратиться на синтез глюкозы, так что это общие затраты на весь глюконеогенез.
Хоть этот процесс и дорогой, но других вариантов у организма нет. Нельзя же бросить мозг и эритроциты — без них тело долго не проживёт.
Взаимосвязь гликолиза и аэробных реакций [ править
Два способа оценки аэробных возможностей организма (прямая оценка показателя максимального устойчивого состояния по лактату и косвенная оценка аэробно-анаэробного перехода) основаны на классической теории активации гликолиза, предложенной А. Хиллом. В основу этой теории легла гипотеза о том, что активация гликолиза в мышечном волокне запускается при снижении аэробного ресинтеза АТФ. Основной причиной снижения аэробного ресинтеза АТФ должно быть неадекватное снабжение клетки кислородом, т.е. фактически снижение внутриклеточного парциального давления кислорода до критического уровня (0,1—0,5 мм рт. ст.), ниже которого нормальное функционирование митохондрий невозможно. Прямо проверить данное предположение оказалось методически достаточно сложно.
В сочетании с сульфатредукцией
Три механизма анаэробного окисления метана (АОМ). Первый метод (вверху) осуществляется консорциумом анаэробных метанотрофных (ANME) архей из клад 1,2a, 2b и 2c и сульфатредуцирующих бактерий (SRB). Окисление метана происходит в ANME, где электроны передаются непосредственно в SRB, который выполняет восстановление сульфата. Второй метод (в центре) связывает окисление метана с восстановлением нитратов, опосредованным консорциумом архей ANME и бактерий Anammox. Третий механизм (внизу) также связывает окисление метана с восстановлением нитратов, но его опосредуют археи ANME и бактерии NC10. В отличие от первых двух механизмов, и археи ANME, и бактерии NC10 конкурируют за метан.
Общая реакция такова:
- CH 4 + SO 4 2− → HCO 3 — + HS — + H 2 O
Сульфат-управляемый АОМ опосредуется синтрофным консорциумом метанотрофных архей и сульфатредуцирующих бактерий . Часто они образуют небольшие агрегаты, а иногда и объемные маты. Партнер архей сокращенно АНМЕ, что означает «анаэробный метанотроф ». ANME очень тесно связаны с метаногенными археями, и недавние исследования показывают, что AOM является ферментативным обращением метаногенеза . До сих пор плохо изучено, как взаимодействуют синтрофические партнеры и какие промежуточные продукты обмениваются между архейной и бактериальной клеткой. Исследованию АОМ препятствует тот факт, что ответственные организмы не были изолированы. Это потому, что эти организмы демонстрируют очень медленные темпы роста с минимальным временем удвоения в несколько месяцев. Бесчисленные усилия по изоляции не смогли изолировать один из анаэробных метанотрофов, возможное объяснение может заключаться в том, что археи ANME и SRB имеют облигатное синтрофическое взаимодействие и поэтому не могут быть изолированы по отдельности.
В бентосных морских районах с сильным выбросом метана из ископаемых резервуаров (например, на холодных выходах , грязевых вулканах или отложениях газовых гидратов ) АОМ может быть настолько высоким, что хемосинтезирующие организмы, такие как нитчатые серные бактерии (см. Beggiatoa ) или животные (моллюски, трубчатые черви) с симбионтами Сульфидокисляющие бактерии могут процветать за счет большого количества сероводорода , производимого во время АОМ. Бикарбоната (HCO 3 — ) , полученная от отита может (я) получить поглощенную в осадках осаждения карбоната кальция или так называемых метан , полученные аутигенных карбонаты и (II) получают выпущен в покрывающей толщу воды. Полученные из метана аутигенные карбонаты, как известно, являются наиболее обедненными 13 C карбонатами на Земле, со значениями δ 13 C до -125 промилле .
Физиологическое значение
Гликолиз можно считать универсальным способом катаболизма глюкозы. Его активно используют про- и эукариотические организмы. Ферменты, являющиеся катализаторами гликолиза, растворяются в воде, накапливаются в цитозоле. Часть клеток и тканей животных могут катаболизировать гексозу только путем гликолиза. Например, подобные способности есть у клеток почечных каналов, нейронов мозга.
В жировой ткани и печени есть некоторые отличия в физиологической роли гликолиза. При пищеварении в жировой ткани и в печени данный процесс является источником субстратов, используемых в синтезе жиров.
Часть тканей растений запасают крахмал в клубнях. Водные растения энергию получают через гликолиз.
В анаэробных условиях происходит превращение пирувата в этанол и лактат. Процесс сопровождается выделением большого количества энергии.
Гликолиз имеет существенное физиологическое значение в адипоцитах. С его помощью вместо окислительного процесса происходит липогенез, позволяющий снижать окислительный стресс.
Получение глюкозы
Реакция была впервые изучена А.М. Бутлеровым. Синтез проходит в присутствии гидроксида кальция:
6CH2=On → C6H12O6
Фотосинтез
В растениях углеводы образуются в результате реакции фотосинтеза из CO2 и Н2О:
6CO2 + 6H2O → C6H12O6 + 6O2
| Фруктоза — структурный изомер глюкозы. Это кетоноспирт (кетоза): она тоже может существовать в циклических формах (фуранозы). |
Она содержит шесть атомов углерода, одну кетоновую группу и пять гидроксогрупп.
| Фруктоза | α-D-фруктоза | β-D-фруктоза |
Фруктоза – кристаллическое вещество, хорошо растворимое в воде, более сладкое, чем глюкоза.
В свободном виде содержится в мёде и фруктах.
Химические свойства фруктозы связаны с наличием кетонной и пяти гидроксильных групп.
При гидрировании фруктозы также получается сорбит.
| Дисахариды – это углеводы, молекулы которых состоят из двух остатков моносахаридов, соединенных друг с другом за счет взаимодействия гидроксильных групп (двух полуацетальных или одной полуацетальной и одной спиртовой). |
В сочетании с восстановлением нитратов и нитритов
Общие реакции:
- CH 4 + 4 NO 3 — → CO 2 + 4 NO 2 — + 2 H 2 O
- 3 CH 4 + 8 NO 2 — + 8 H + → 3 CO 2 + 4 N 2 + 10 H 2 O
Недавно было показано, что ANME-2d отвечает за АОМ, управляемый нитратами. ANME-2d, названный Methanoperedens nitroreducens , способен выполнять АОМ, управляемый нитратами, без организма-партнера посредством обратного метаногенеза с нитратом в качестве концевого акцептора электронов, используя гены восстановления нитратов, которые были переданы латерально от бактериального донора. Это также был первый полный путь обратного метаногенеза, включающий гены mcr и mer .
В 2010 году омики , особенно метагеномические , анализ показали, что восстановление нитрита может быть связано с окислением метана одним бактериальным видом Candidatus Methylomirabilis oxyfera ( тип NC10 ), без необходимости в архейном партнере.
Степень аэробности среды
Степень аэробности среды характеризуется прежде всего ее окислительно-восстановительным потенциалом – физической величиной, выражаемой в вольтах и измеряемой посредством потенциометрии. В среде, максимально насыщенной кислородом, показатель может достигать 41. При насыщении среды водородом он приближается к нулю. Число 28 позволяет делать выводы о том, что процессы окисления и равновесия сбалансированы.
Наблюдается четкая зависимость между окислительно-восстановительным потенциалом среды и параметрами жизнедеятельности организмов. Таким образом, воздействуя на него и меняя на свое усмотрение, можно регулировать их численность. Однако не стоит забывать и об обратной зависимости: выделяя продукты обмена, а также используя адаптационные механизмы, микроорганизмы также могут вилять на окислительно-восстановительный потенциал среды, в которой они находятся.
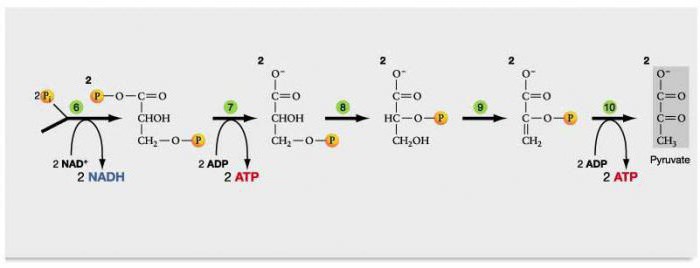
Бескислородное окисление глюкозы включает два этапа
В анаэробном процессе пировиноградная кислота восстанавливается до молочной кислоты (лактата), поэтому в микробиологии анаэробный гликолиз называют молочнокислым брожением. Лактат является метаболическим тупиком и далее ни во что не превращается, единственная возможность утилизовать лактат – это окислить его обратно в пируват.
Многие клетки организма способны к анаэробному окислению глюкозы. Для эритроцитов он является единственным источником энергии.
Клетки скелетной мускулатуры за счет бескислородного расщепления глюкозы способны выполнять мощную, быструю, интенсивную работу, как, например, бег на короткие дистанции, напряжение в силовых видах спорта.
Вне физических нагрузок бескислородное окисление глюкозы в клетках усиливается при гипоксии – при различного рода анемиях, при нарушении кровообращения в тканях независимо от причины.
Первый этап гликолиза – подготовительный, здесь происходит затрата энергии АТФ, активация глюкозы и образование из нее триозофосфатов.
Первая реакция гликолиза сводится к превращению глюкозы в реакционно-способное соединение за счет фосфорилирования 6-го, не включенного в кольцо, атома углерода. Эта реакция является первой в любом превращении глюкозы, катализируется гексокиназой.
Вторая реакция необходима для выведения еще одного атома углерода из кольца для его последующего фосфорилирования (фермент глюкозофосфат-изомераза). В результате образуется фруктозо-6-фосфат.
Третья реакция – фермент фосфофруктокиназа фосфорилирует фруктозо-6-фосфат с образованием почти симметричной молекулы фруктозо-1,6-дифосфата. Эта реакция является главной в регуляции скорости гликолиза.
В четвертой реакции фруктозо-1,6-дифосфат разрезается пополам фруктозо-1,6-дифосфат-альдолазой с образованием двух фосфорилированных триоз-изомеров – альдозы глицеральдегида (ГАФ) и кетозы диоксиацетона (ДАФ).
Пятая реакция подготовительного этапа – переход глицеральдегидфосфата и диоксиацетонфосфата друг в друга при участии триозофосфатизомеразы. Равновесие реакции сдвинуто в пользу диоксиацетонфосфата, его доля составляет 97%, доля глицеральдегидфосфата – 3%. Эта реакция, при всей ее простоте, определяет дальнейшую судьбу глюкозы:
- при нехватке энергии в клетке и активации окисления глюкозы диоксиацетонфосфат превращается в глицеральдегидфосфат, который далее окисляется на втором этапе гликолиза,
- при достаточном количестве АТФ, наоборот, глицеральдегидфосфат изомеризуется в диоксиацетонфосфат, и последний отправляется на синтез жиров.
Второй этап гликолиза – это освобождение энергии, содержащейся в глицеральдегидфосфате, и запасание ее в форме АТФ.
Шестая реакция гликолиза (фермент глицеральдегидфосфат-дегидрогеназа) – окисление глицеральдегидфосфата и присоединение к нему фосфорной кислоты приводит к образованию макроэргического соединения 1,3-дифосфоглицериновой кислоты и НАДН.
В седьмой реакции (фермент фосфоглицераткиназа) энергия фосфоэфирной связи, заключенная в 1,3-дифосфоглицерате тратится на образование АТФ.
Реакция получила дополнительное название – реакция субстратного фосфорилирования, что уточняет источник энергии для получения макроэргической связи в АТФ (от субстрата реакции) в отличие от окислительного фосфорилирования (от электрохимического градиента ионов водорода на мембране митохондрий).
Восьмая реакция – синтезированный в предыдущей реакции 3-фосфоглицерат под влиянием фосфоглицератмутазы изомеризуется в 2-фосфоглицерат.
Девятая реакция – фермент енолаза отрывает молекулу воды от 2-фосфоглицериновой кислоты и приводит к образованию макроэргической фосфоэфирной связи в составе фосфоенолпирувата.
Десятая реакция гликолиза – еще одна реакция субстратного фосфорилирования – заключается в переносе пируваткиназой макроэргического фосфата с фосфоенолпирувата на АДФ и образовании пировиноградной кислоты.
Последняя реакция бескислородного окисления глюкозы, одиннадцатая – образование молочной кислоты из пирувата под действием лактатдегидрогеназы
Важно то, что эта реакция осуществляется только в анаэробных условиях. Эта реакция необходима клетке, так как НАДН, образующийся в 6-й реакции, в отсутствие кислорода не может окисляться в митохондриях
| У плода и детей первых месяцев жизни преобладает анаэробный распад глюкозы, в связи с чем концентрация молочной кислоты в крови у них выше чем у взрослых. |
| При наличии кислорода пировиноградная кислота переходит в митохондрию и превращается в ацетил-S-КоА. |






