Гормоны щитовидной железы
Содержание:
- Список литературы
- Особенности щитовидного гормонального обмена
- Влияние тиреоидных гормонов на костный метаболизм
- Оценка адекватности различных вариантов заместительной терапии гипотиреоза
- Материалы и методы
- Один гормон или два?
- Тиреотропный гормон и механизм его влияния на клетки
- Эффекты антител к рецептору ТТГ в костной ткани
- Филиалы и отделения, в которых лечат рак щитовидной железы
- Физиология тиреоидных гормонов и механизм их действия на клеточном уровне
- Применение Т3 в психиатрии
- Классификация рака щитовидной железы (по TNM)
- Обмен тиреоидных гормонов
Список литературы
1. Aghlni-Lombardi P., Antonangeli L, Martina E. et al. // J. Clin. Endocrinol. Metab. — 1999. — Vol.84, № 2. — P. 561-566.
2. Braverman L.E., Ingbar S.H., Sterling K. // J. Clin. Invest. — 1970. — Vol.49, № 5. — P. 855-864.
3. Bunevičius R., Kažanavičius G., Žalinkevičus R., Prange A.J. // N. Engl. J. Med. — 1999. — Vol.340, № 6. — P. 424-429.
4. Evered D., Young E.Т., Ormston B.J. et al. // Br. Med. J. — 1973. — Vol.3, № 5872. — P. 131-134.
5. Fish L. H., Schwartz H. L, Cavanaugh J. et al. // N. Engl. J. Med. — 1987. — Vol.316. — P. 764.
6. Gordin A., Heinonen O.P., Saarinen P., Lamberg B.A. // Lan- cet. — 1972. — Vol.1, № 7750. — P. 551-554.
7. Gow S.M., Caldwetl G., Toft A.D. et al. // J. Clin. Endocri- nol. Metab. — 1987. — Vol.64, № 2. — P. 364-370.
8. Haggerty J.J., Prange A.J. // Ann. Rev. Med. — 1995. — Vol.46. — P. 37-46.
9. Helfand M., Crapo L.M. // Ann. Intern. Med. — 1990. — Vol.113, № 6. — P. 450-454.
10. Howland R.H. // J. Clin. Psychiatry. — 1993. — Vol.54, № 2. — P. 47-54.
11. Inada M., Nishikawa M., Naito K. et al. // Endocrinol. Jpn. — 1980. — Vol.27, № 3. — P. 291-295.
12. Jacksonl. M. // Thyroid. — 1996. — Vol.6, № 1. — P. 63-67.
13. Joffe R.Т., Levitt A.J. // Psychoneuroendocrinology. — 1992. — Vol.17, № 2-3. — P. 215-221.
14. Lindsay R.S., Toft A.D. // Lancet. — 1997. — Vol.349, № 9049. — P. 413-417.
15. Mazzaferri E.L. // N. Engl. J. Med. — 1999. — Vol.340, № 6. — P. 430.
16. Nemeroff C.B. // J. Clin. Psychiatry. — 1991. — Vol.52. — Suppl. — P. 21-27.
17. Oldfield S., Ramsden D.В., Stephens K.E. et al. // Clin. Chim. Acta. — 1985. — Vol.145, № 3. — P. 307-311.
18. Oppenheimer J.H., Koerner D., Schwartz H.L., Surks M.I. // J. Clin. Endocrinol. Metab. — 1973. — Vol.35. — P. 330- 333.
19. Oppenheimer J.H., Braverman L.E., Toft A. et al. // J. Clin. Endocrinol. Metab. — 1995. — Vol.80, № 10. — P. 2873- 2876.
20. Pearce C.J., Himsworth R.L. // Br. Med. J. — 1984. — Vol. 288, № 6418. — P. 693-695.
21. Pies R.W. // General Hosp. Psychiatry. — 1997. — Vol.19, № 5. — P. 344-354.
22. Prange A.J.Jr., Wilson I.C., Rabon A.M. // Am. J. Psychiatry. — 1969. — Vol.126, № 4. — P. 457-469.
23. Rack S.K., Makela Eu.H. // Ann. Pharmacother. — 2000. — Vol.34. — P. 1142-1145.
24. Rendell M. et al. // Clin. Endocrinol. — 1985. — Vol.22, № 6. — P. 693-700.
25. Ross D.S. // Endocrinol. Metab. Clin. N. Am. — 2001. — Vol.30, № 2. — P. 245-264.
26. Roti E., Minelli R., Gardini E., Braverman L.E. // Endocr. Rev. — 1993. — Vol.14, № 4. — P. 401-423.
27. Salmon D., Rendell M., Willims J. et al. // Arch. Intern. Med. — 1982. — Vol.142, № 3. — P. 571-573.
28. Silva J.E., Dick T.E., Larsen P.R. // Endocrinology. — 1978. — Vol.103, № 4. — P. 1196-1207.
29. Smith R.N., Taylor S.A., Massey J.C. // Br. Med. J. — 1970. — Vol.4. — P. 145-148.
30. Stock J.M., Surks M.L, Oppenheimer J.H. // N. Engl. J. Med. — 1974. — Vol.290. — P. 529-533.
31. Surks M.L, Schadlow A.R., Stock J.M., Oppenheimer J.H. //J. Clin. Invest. — 1973. — Vol.52, № 4. — P. 805-811.
32. Tigas S., Idiculla J., Beckett G., Toft A. // Thyroid. — 2000. — Vol.10, № 12. — P. 1107-1111.
33. Toft A.D. // N. Engl. J. Med. — 1994. — Vol.331, № 3. — P. 174-180.
34. Toft A.D. // N. Engl. J. Med. — 1999. — Vol.340. — P. 469-470.
35. Walsh J.P., Stuckey B.G.A. // Med. J. Aust. — 2001. — Vol.174. — P. 141-143.
36. Weetman A.P. // Br. Med. J. — 1997. — Vol.314. — P. 1175-1178.
37. Weinberg A.D., Brennan M.D., Gorman C.A. et al. // Arch. Intern. Med. — 1983. — Vol.143, № 5. — P. 893-897.
38. Williams Textbook of Endocrinology. — 9-th Ed. — Philadelphia, 1998.
39. Woeber K.A. // J. Endocrinol. Invest. — 2002. — Vol.25. — P. 106-109.
Особенности щитовидного гормонального обмена
Постарайтесь внимательно прочесть и понять содержание этого подраздела. Следующие сведения очень важны для оценки анализа крови. Эти знания послужат ключом к пониманию данных анализа.свободном
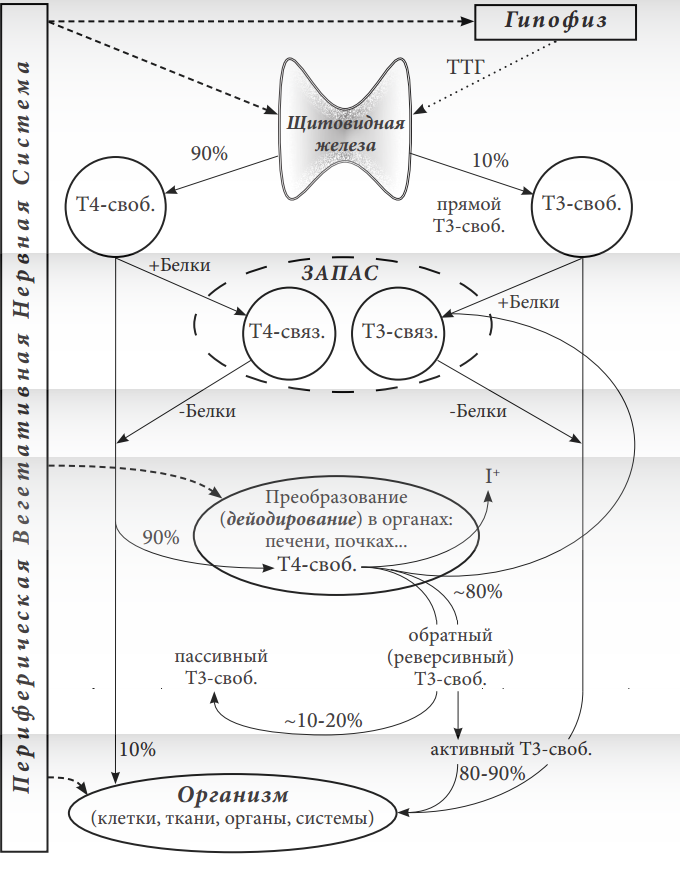 Рисунок 2. Схема обмена гормонов щитовидной железы (Т4 и Т3) с пояснениями.
Рисунок 2. Схема обмена гормонов щитовидной железы (Т4 и Т3) с пояснениями.
1 уровень.2 уровень.3 уровень.4 уровень.5 уровень.связаннымисвободнымиТолько свободные гормоны оказывают биологическое действие.Связанные гормоны не активны.связанныхсвободныхобщихпоступающихсвязываемыхгормон Т4 в 4-5 раз менее активен по сравнению с гормоном Т3Т4 можно рассматривать как полуфабрикат, из которого создаётся главный гормон ― Т3

Цитаты из книги
М.И. Балаболкин, Е.М. Клебанова, В.М. Креминская «Фундаментальная и Клиническая Тироидология». Руководство для врачей. М.: Медицина, 2007, 816 с. В следующем изложении авторы под Т3 и Т4 представляют свободные формы щитовидных гормонов. Стр. 121: «Наибольшее биологическое действие имеет Т3, который активнее Т4 в 4-5 раз. В течение длительного времени считалось, что Т4 и Т3 в равной степени принимают участие в обмене веществ. Однако было показано, что на периферии Т4 конвертируется (переходит) в Т3 и биологическое действие тиреоидных гормонов более чем на 90-92% осуществляется за счёт Т3. Применение радиоиммунологического метода для определения концентрации Т3 в сыворотке крови позволило установить, что около 80% циркулирующего в крови Т3 является производным от Т4 в следствие его периферического монодейодирования, и только 20% Т3 сыворотки непосредственно образуется в щитовидной железе». Стр. 122: «… почти 100% действия тиреоидных гормонов осуществляется Т3, а не Т4…». Стр. 134: «Основная роль тироксина в организме заключается в том, что он является своего рода источником или, правильнее, прогормоном, для Т3, который и оказывает биологическое действие в тканях организма».
дейодированиедейодиназы

Цитаты из книги
Г.М. Кроненберг, Ш. Мелмед, К.С. Полонски, П.Р. Ларсен «Заболевания щитовидной железы». Пер. с англ. под ред. И.И. Дедова, Г.А. Мельниченко. М.: ООО «Рид Элсивер», 2010, 392 с.
Авторы сообщают, что в организме из Т4св. образуется 80% активного гормона Т3св., путём отсоединения от него одного атома йода (с помощью специальных ферментов ― дейодиназ). Лишь малая часть гормона Т3 неактивна. Стр. 37: «Нужно отметить, что тканями захватываются, действуют на них, подвергаются дейодированию и инактивации только свободные тиреоидные гормоны. Связанная же их форма служит резервуаром». Стр. 40: «Наиболее значимый путь метаболизма Т4 ― его монодейодирование по наружному кольцу в 5ʾ-положении. Результатом может быть продукция активной формы тиреоидных гормонов, Т3. Эта реакция катализируется дейодиназами 1-го и 2-го типов (D1 и D2) и служит источником примерно 80% всего Т3, циркулирующего в крови человека». Авторы указывают на ведущее участие периферической вегетативной нервной системы (её симпатической части) в регуляции образования Т3св. из Т4св., путём влияния на активность дейодиназы D2 . Стр. 45: «Поскольку экспрессия кодирующего D2 гена Din2 возрастает под влиянием цАМФ, в бурой жировой ткани при холодовой стимуляции симпатических нервных волокон быстро нарастают активность D2 и продукция Т3».
Т3св. ― важный и обязательный показатель!Только Т3св. преимущественно потребляется организмом и лучше оказывает энергообразующее действие, чем Т4св.активнапассивнареверсивнымобратнымгипотезыпрактикавидеть факты и понимать ихнежелание познавать и совершенствоватьсявсегда, как минимум, совместно определять три показателя: ТТГ, Т4св. и Т3св. ключевым
Влияние тиреоидных гормонов на костный метаболизм
Т3 способен влиять на функцию остеобластов как прямым воздействием через TRa-рецепторы, так и опосредованно. 13 частности, Т3 стимулирует синтез остеокальцина, коллагена 1-го типа и щелочной фосфатазы, а также индуцирует проангио- генный фактор коллагеназу—3/матрикс металлопротеиназы 13 (ММР13), желатиназу—В (ММР9) и тканевый ингибитор матрикс металлопротеиназы . Кроме того, Т3 опосредованно регулирует ответ остеобластов на паратиреоидный гормон через изменение синтеза рецепторов к паратгормону , увеличение скорости дифференцировки остеобластов и апоптоза и стимуляцию синтеза RANKL . Также Т3 влияет на экспрессию гена рецептора фактора роста фибробластов 1 (FGFR1), что может иметь значение в пропроли- феративном и проапоптотическом действии Т3 . Наиболее вероятно, что Т3 влияет на резорбцию костной ткани остеокластами опосредованно, через стимулирование интерлейкина-6 (IL-6), интерлейкина-8 (IL-8), простагландина Е2 и других цитокинов, вовлеченных в остеокластогенез . Т3 также стимулирует синтез инсулиноподобного фактора роста 1 (IGF-1) и его регуляторных связывающих протеинов (IGF-1 ВР-2 и ВР-4) . Эти наблюдения показывают, что Т3 прямо и косвенно способствует пролиферации остеобластов, их дифференцировке и апоптозу (рис. 2). В то же время стимуляция Т3 остеокластов приводит только к резорбции костной ткани и действие Т3 на остеокласты происходит через стимуляцию IGF-1, а также воздействие на фактор роста фибробластов (FGF), IL-6, простагландины и индукцию RANKL (см. рис. 2) . Здесь же необходимо отметить протективный эффект эстрогенов на кость, отсутствие которого усугубляет потерю костной ткани у пациентов с избытком тиреоидных гормонов. Эстрогены уменьшают остеокластогенез через увеличение OPG и подавление синтеза интерлейкина-1 (IL-1), IL-6, фактора некроза опухолей a (TNFa) и макрофаг-ко- лониестимулирующего фактора (M-CSF). Кроме того, эстрогены оказывают регулирующее влияние на IGF-1 (хотя ответ может зависеть от пола) и способны увеличивать трансформирующий фактор роста р (TGFJ3), который снижает активность остеокластов и увеличивает их апоптоз (см. рис. 2) .
Таким образом, при увеличении концентрации тиреоидных гормонов сверх физиологической нормы время всех фаз костного ремоделирования уменьшается, а частота появления участков ремоделирования увеличивается, т. е. активность остеобластов и остеокластов увеличивается, а цикл ремоделирования уменьшается на 50%. Эти изменения непропорциональны (активность остеокластов и остеобластов увеличивается неодинаково), что приводит к потере 10% массы кости за один цикл ремоделирования и увеличению риска развития переломов .
Оценка адекватности различных вариантов заместительной терапии гипотиреоза
В настоящее время критерием адекватности заместительной терапии гипотиреоза считается нормальный уровень ТТГ, определенный методом с высокой чувствительностью . Наряду с господствующим мнением о том, что уровень ТТГ является надежным маркером адекватности заместительной терапии, были опубликованы работы, исследующие уровень периферических тиреоидных гормонов на фоне различных вариантов заместительной терапии гипотиреоза.
В начале 80-х годов ряд авторов высказывали мнение о том, что подавление уровня ТТГ на фоне терапии L-T4 обусловлено влиянием Т3, конвертированного из Т4 в тиреотрофах, поэтому уровень ТТГ не может служить достаточным критерием для оценки адекватности терапии первичного гипотиреоза, вместе с ним целесообразно определять уровень Т3 сыворотки. Кроме того, существовало мнение о том, что достижение эутиреоза в периферических тканях возможно только при повышенном уровне Т4 сыворотки, который обеспечит достаточную конверсию в Т3 . Таким образом, критериями достижения эутиреоза служили нормальный уровень Т3 сыворотки и нормальный ответ ТТГ на стимуляцию ТРГ, а определять уровень Т4 сыворотки считалось нецелесообразным.
В ряде проведенных работ было показано, что на фоне монотерапии L-T4 при нормальных условиях ТТГ и Т3 сыворотки отмечается повышение уровня Т4 . Соответственно нормальные уровни Т4 и ТТГ сыворотки сопровождаются более низкими значениями Т3, чем у здоровых лиц . Следовательно, отношение Т4 к Т3 значительно выше у больных гипотиреозом на фоне монотерапии L-T4, чем у здоровых. По мнению К. Woeber, более высокое отношение Т4 к Т3 обусловлено подавлением остаточной секреции Т3 щитовидной железой и низким уровнем конверсии Т4 в Т3 на периферии на фоне экзогенного L-T4. В проведенных ранее исследованиях уже было показано, что заместительная терапия гипотиреоза Ь-Т4 сопровождается увеличением отношения Т4 к Т3 в крови , и этот показатель возрастает с увеличением дозы L-T4.
По мнению К. Woeber, более высокий уровень Т4 и более низкий — Т3 на фоне заместительной терапии L-T4 при сравнении со здоровыми обусловлены тем, что секреция ТТГ регулируется преимущественно Т4 сыворотки. Поэтому на фоне монотерапии Ь-Т4 при нормальном уровне ТТГ уровень Т3 в крови может быть низким. По данным К. Woeber, из 35 пациентов, получавших заместительную терапию Ь-Т4, у 4 уровень Т3 был сниженным, а у 3 — на нижней границе нормы . Также по данным R. Bunevicius и соавт., у пациентов на фоне монотерапии L- Т4, уровень общего Т3 был близок к нижней границе нормы . Означают ли эти данные, что для терапии гипотиреоза целесообразно использование комбинации L-T4 и L-T3 или что гипер- тироксинемия на фоне монотерапии L-T4 обеспечивает нормальный уровень Т3 в клетках? По мнению К. Woeber, на этот вопрос можно ответить только методом непосредственного определения уровня Т3 в тканях .
Такие исследования проводили на животных. Было показано, что у крыс после тиреоидэктомии монотерапия Т4 не позволяет достичь нормального уровня тиреоидных гормонов в крови и в тканях. Для достижения нормальной концентрации Т3 в тканях требовалось назначение или более высоких доз L-T4, что сопровождалось подавлением продукции ТТГ, или комбинации Т4 и Т3, что позволяло нормализовать уровни Т3, Т4 и ТТГ в сыворотке, а также Т4 и Т3 в периферических тканях. Если такая закономерность справедлива для человека, то назначение комбинации Т3 и Т4 при гипотиреозе может быть более физиологичным, чем монотерапия Т4 .
Материалы и методы
Обследованы 75 больных РА (61 (81,4%) женщина и 14 (18,6%) мужчин) в возрасте 25—78 лет, находившихся на стационарном лечении в Клинической больнице № 25 Волгограда. Из них 35 (46,6%) женщин и 11 (14,6%) мужчин относились к социально-активному населению, т. е. находились в возрастных группах до 55 и 60 лет соответственно. Таким образом, значительная (45 (60%)) часть больных РА) принадлежала к трудоспособному возрасту. Средний возраст пациентов составил 54,1 ± 11,6 года. Средняя продолжительность заболевания — 9,47 ± 8,83 года.
Контрольную группу составили 30 практически здоровых лиц — доноров областной станции переливания крови в возрасте от 24 до 56 лет (22 женщины и 11 мужчин), прошедших предварительное медицинское обследование.
Диагноз РА ставили на основании тщательного клинико-лабораторного и инструментального обследования больных в соответствии с рабочей классификацией и номенклатурой ревматических заболеваний, рекомендованной III Всесоюзным съездом ревматологов, и согласно системе диагностических критериев Американской ревматологической ассоциации (1987 г.). Активность ревматического процесса оценивали на основании клинических данных, иммунобиохимических показателей и индекса DAS 28 (Disease Activity Score).
В ходе наблюдения проводили: сбор жалоб и анамнеза, осмотр, физикальное исследование и комплекс общелабораторных тестов, выполняли иммунологические анализы. Методом ИФА определяли количество ТТГ, свободного Т4 (св. Т4), общего Т3 («Алкор-Био», Санкт-Петербург) и свободного Т3 (св. Т3) (ЗАО «НВО Иммунотех», Москва), антител к ТПО и ТГ (ООО «ХЕМА-МЕДИКА», Москва). По показаниям проводили инструментальные исследования: ЭКГ, рентгенографию органов грудной клетки и суставов, УЗИ сердца, органов брюшной полости и ЩЖ. Исследование проводили в соответствии с принципами Хельсинкской декларации Международной медицинской ассоциации и рекомендациями по этике биомедицинских исследований .
Суставная форма РА отмечалась у 45 (60%) человек, причем 23 (51%) из них имели полисустав- ную форму заболевания. Системные проявления РА отмечены у 30 (40%) пациентов. Среди больных РА признаки тиреоидной патологии обнаружены в 11 (14,6%) случаях. Из них диффузно-токсический зоб (ДТЗ) с тиреотоксикозом наблюдался у 4 человек, первичный гипотиреоз (повышен уровень ТТГ) — у 2, повышение уровня антител к ТПО и ТГ — у 5 пациентов.
При определении содержания антител к Т3 (ан- ти-Т3) и Т4 (анти-Т4) в сыворотке крови методом твердофазного ИФА использовали иммобилизированные гранулированные антигенные препараты с магнитными свойствами в модификации Т. П. Гон- таря и соавт. с получением растворимых форм гормонов Т3 и Т4 (из коммерческих препаратов «Berlin-Chemie», Германия). Результаты выражали в единицах оптической плотности (ед. опт. пл.) и считали положительными при превышении более чем на 2ст величин экстинции контрольной группы.
Полученные данные анализировали с использованием статистической программы «Statistica 6.0» (StatSoft, США). Данные представлены в виде среднего (М) и стандартного отклонения (ст), также использовался расчет медианы (Me) и 25% и 75% процентилей, если распределение показателя отличалось от нормального. Статистический анализ провели с использованием теста х2 Для качественных данных, /-критерия Стьюдента и критерия Манна—Уитни. Для оценки зависимости между количественными признаками использовали коэффициент корреляции Спирмена. Критический уровень значимости различий принимали равным 0,05.
Рис. 1. Количество антител к трийодтиронину (ось ординат) у больных РА и здоровых лиц (ось абсцисс).
Один гормон или два?
На сегодняшний день возникает совершенно закономерный вопрос: целесообразно ли назначать всем больным с гипотиреозом комбинированную терапию Т4 и Т3? Как следует из представленного обзора литературы, однозначного ответа на этот вопрос пока нет: есть аргументы как за, так и против. Тем не менее на основании представленных данных и клинической практики можно сделать вывод о том, что существует группа пациентов, у которых комбинированная заместительная терапия более оправдана. К сожалению, на сегодняшний день отсутствуют объективные критерии, на основании которых тот или иной вариант терапии можно было бы назначать дифференцированно.
Наряду с этим можно сделать вывод о том, что глубокое изучение поднятого вопроса на современном методологическом уровне является весьма актуальным
При этом нужно обратить внимание на то, что наряду с изучением психологических и нейрофизиологических показателей необходимо оценить и другие параметры, такие как толерантность к физической нагрузке, сократимость миокарда и др.
Тиреотропный гормон и механизм его влияния на клетки
В настоящее время есть основания предполагать, что не только тиреоидные гормоны, но и ТТГ оказывают прямое физиологическое влияние на костную ткань. ТТГ — это гликопротеиновый гормон передней доли гипофиза, состоящий из двух нековалентно связанных субъединиц — аир . Ген а-субъединицы локализован на хромосоме 6, и структурно эта часть одинакова у всех гликопротеидных гормонов гипофиза. Ген р-субъединицы локализован на хромосоме 1 и р-субъединица специфична для ТТГ . ТТГ является основным гормоном, необходимым для развития щитовидной железы, синтеза и секреции тиреоидных гормонов . Реализация эффектов ТТГ осуществляется через связь со специфическим рецептором к тиреотропному гормону (ТТГ-Р) . ТТГ-Р представляет собой одноцепочечный гликопротеид, содержащий 764 аминокислоты, ген ТТГ-Р у человека локализован на хромосоме 14q3. Рецептор к тиреотропному гормону принадлежит к семейству рецепторов гликопротеиновых гормонов суперсемейства парных G-проте- ин-трансмембранных рецепторов . Структурно ТТГ состоит из внешней части — эктодомена, или субъединицы А, которая вовлечена в связь с лигандом, и внутренней части — субъединицы В, включающей трансмембранную и внутриклеточную части . Через субъединицу В реализуются такие эффекты ТТГ, как развитие клеток щитовидной железы, синтез тиреоидных гормонов и их высвобождение .
Связь ТТГ с рецептором приводит к активации системы G-протеин-аденилатциклаза — циклический аденозинмонофосфат (цАМФ), а также может быть активирована фосфатидилинозитолфосфатная система с увеличением концентрации внутриклеточного кальция (рис. 3). В клетках щитовидной железы изменения уровня внутриклеточного кальция и фосфолипаза С регулируют расход йода, продукцию перекиси водорода и йодирование тиреоглобулина, тогда как аденилат- циклаза и цАМФ регулируют поглощение йода и транскрипцию тиреоглобулина, тиреоидной пероксидазы и на- трий-йодидного транспортера .
Многие исследования показали присутствие рецептора ТТГ не только в ткани щитовидной железы, но и в клетках других органов. В частности, экспрессия рецептора ТТГ была обнаружена в лимфоцитах , тимусе , гипофизе , яичках , почках , головном мозге , жировой ткани и фибробластах , сердце , скелетной мускулатуре, в том числе экст- раорбитальных мышцах , коже , кишечнике , печени и поджелудочной железе и костях .
Эффекты антител к рецептору ТТГ в костной ткани
Наличие рецептора ТТГ на костных клетках предполагает определение роли стимулирующих антител к рецептору ТТГ при болезни Грейвса. В то же время дефицит ТТГ, который, согласно мнению Е. Abe, приводит к увеличению как костеобразования, так и резорбции, мог бы парадоксально компенсироваться влиянием стимулирующих антител
, однако степень стимуляции рецептора ТТГ должна зависеть от уровня антител и может быть весьма различной. Подавление костного метаболизма не обязательно должно приводить к увеличению прочности кости и соответственно снижению риска переломов. Если же за основу объяснения физиологической роли ТТГ в костной ткани взять его способность увеличивать экспрессию D2 , то получится, что антитела к рецептору ТТГ при болезни Грейвса могут увеличивать уровень локальной продукции Т3 и, следовательно, усиливать потерю костной массы у пациентов с диффузным токсическим зобом.
Таким образом, тиреоидные гормоны необходимы для нормального развития, роста и минерализации скелета. Повышение содержания тиреоидных гормонов приводит к повышению как костной резорбции, так и костеобразования, однако с преобладанием костной резорбции, которая становится более выраженной в отсутствие протективного действия эстрогенов.
Филиалы и отделения, в которых лечат рак щитовидной железы
ФГБУ «НМИЦ радиологии» Минздрава России обладает всеми необходимыми технологиями лучевого в том числе и радионуклидного, химиотерапевтического, хирургического лечения, включая расширенные и комбинированные операции и методики. Все это позволяет выполнить необходимые этапы лечения в рамках одного Центра, что исключительно удобно для пациентов.
МРНЦ имени А.Ф. Цыба – филиала ФГБУ «НМИЦ радиологии» Минздрава России обладает уникальной возможностью лечить рак щитовидной железы, помимо традиционных методик лечения, в том числе закрытыми и открытыми радионуклидами.
1. Отдел лучевого и хирургического лечения опухолей головы и шеи МРНЦ имени А.Ф. Цыба – филиала ФГБУ «НМИЦ радиологии» Минздрава России г. Обнинск, Калужской области
Заведующий – к.м.н., хирург-онколог СЕВРЮКОВ Феликс Евгеньевич.Тел: +7 (484) 399-31-30
2. Отделение радиохирургического лечения закрытыми радионуклидами МРНЦ имени А.Ф. Цыба – филиала ФГБУ «НМИЦ радиологии» Минздрава России г. Обнинск, Калужской области
Заведующий – д.м.н., профессор, хирург-онколог МЕДВЕДЕВ Виктор СтепановичКонтакты: +7 (484) 399-31-30
3. Отделение радиохирургического лечения открытыми радионуклидами МРНЦ имени А.Ф. Цыба – филиала ФГБУ «НМИЦ радиологии» Минздрава России г. Обнинск, Калужской области
Заведующий – д.м.н., врач-радиолог КРЫЛОВ Валерий ВасильевичКонтакты: +7 (484) 399-31-30
4.Отделение микрохирургии МНИОИ имени П.А. Герцена – филиала ФГБУ «НМИЦ радиологии» Минздрава России
Заведующий – д.м.н, хирург-онколог ПОЛЯКОВ Андрей ПавловичКонтакты: +7 (495) 150-11-22
Физиология тиреоидных гормонов и механизм их действия на клеточном уровне
Прогормон 3,5,3′,5′-Ь-тетрайодтиронин (Т4) синтезируется в щитовидной железе вместе с небольшим количеством активного гормона 3,5,3′- L-трийодтиронина (Т3). Ферменты йодтиронин- дейодирования (D) переводят Т4 в Т3 через 5′-мо- нодейодирование, при этом в тканях человека преобладает дейодиназа D2 . Дейодиназа D3 (D3) инактивирует Т4 и Т3 через 5-монодейодирование. Внутриклеточная концентрация Т3 зависит от относительной активности разных дейодиназ (рис. 1).
Клеточные влияния Т3 опосредуются через рецептор тиреоидных гормонов, который является членом семейства ядерных рецепторов и функционирует как индуцируемый Т3 фактор транскрипции (см. рис. 1) . Т, обладает в 100 раз меньшей аффинностью к ядерным рецепторам по сравнению с Т3 и не вызывает активацию транскрипции . Т3-рецепторы a (TRa) и . Как THRA-, так и THRB-гены транскрибируются как множественные РНК-изоформы . Внутри ядра рецепторы к Т3 связаны как гетеродимеры с ретиноидными Х-рецепторами (RXR) для спецификации гормоночувствительных элементов в регионе промотора чувствительных генов . В отсутствие Т3 несвязанный RXR-TR гетеродимер присоединяется к элементам генов, транскрибируемых тиреоидными гормонами (thyroid-response elements — TRE), и таким образом опосредует подавление транскрипции. Связь Т3 приводит к диссоциации комплекса корепрессора, восстановлению комплекса коактиватора и, следовательно, активации транскрипции генов, чувствительных к тиреоидным гормонам (см. рис. 1) .
Экспериментальные исследования на животных показали, что в костной ткани преобладает экспрессия рецептора к тиреоидным гормонам a (TRa) , тогда как рецептор к тиреоидным гормонам р (TR. У мышей TRa (0/0), лишенных всех изоформ рецептора TRa, развивается задержка роста с отсроченной оссификацией костей и сниженной минерализацией, несмотря на эутиреоз . Такие изменения скелета сходны с клинической картиной гипотиреоза у детей. В то же время у мышей TRp (-/-), полностью лишенных TRp-изоформ, наблюдалась клиническая картина резистентности к тиреоидным гормонам при нормальном развитии скелета . Однако мыши TRa (0/0) TRp (-/-) имели более выраженные изменения со стороны костной системы, чем TRa (0/0), что показывает возможность частичной компенсации TRp при отсутствии TRa в костях . Кроме того, селективный агонист TRp, используемый у грызунов с врожденным гипотиреозом, позволяет частично восстановить развитие скелета и его созревание , хотя использование Т3 дает значительно лучшие результаты. Таким образом, преобладание функциональной активности различных изоформ тиреоидного рецептора в той или иной ткани может оказывать селективное влияние на органы и использоваться в терапии, а также для предотвращения побочных эффектов проводимой терапии тиреоидными гормонами .
Применение Т3 в психиатрии
Еще одним аспектом применения тиреоидных гормонов является их эффективность у больных с депрессией. Впервые сведения о взаимосвязи гипотиреоза и депрессии появились более 100 лет назад — в 1888 г. . По современным представлениям, депрессия часто встречается у больных с манифестным гипотиреозом . Примерно у 40% больных с манифестным гипотиреозом (чаще у женщин) отмечаются клинические проявления депрессии , нередко сопровождающиеся психомоторной заторможенностью и умеренным снижением когнитивных функций . Кроме того, депрессия может быть первым проявлением субклинического гипотиреоза . Поданным R. Howland и соавт., примерно у 50% больных с рефрактерной депрессией был выявлен субклинический гипотиреоз . Тяжелая депрессия при субклиническом гипотиреозе отличается от депрессии в отсутствие гипотиреоза наличием панических атак и плохим ответом на проводимую терапию антидепрессантами .
Назначение тиреоидных гормонов повышает эффективность антидепрессантов. Впервые это описали A. Prange и соавт. в 1969 г. . По данным I. Jackson и соавт., терапия трициклическими антидепрессантами неэффективна у 25% больных с униполярной депрессией . Особый интерес вызывает способность небольших доз L-T3 потенцировать действие трициклических антидепрессантов. Так, по данным С. Nemaroff и соавт., примерно у 25% больных с рефрактерной депрессией добавление L-T3 к терапии антидепрессантами повышало эффективность лечения . Однако у больных без гипотиреоза (субклинического или манифестного) монотерапия депрессии тиреоидными гормонами вряд ли будет эффективной .
Как отмечалось ранее, Т3 является активным тиреоидным гормоном в головном мозге, где содержится большое количество рецепторов к Т3. Контроль конверсии Т4 в Т3 в головном мозге обеспечивает D2. Предполагается, что у больных с униполярной депрессией активность этого фермента снижена . Если это предположение справедливо, то становится понятным, почему L-T3 более эффективен, чем Ь-Т4, в лечении нарушений деятельности ЦНС при гипотиреозе. Кроме того, предполагается, что у больных с депрессией, резистентной к терапии, нарушается транспорт Т4 (но не Т3) через гематоэнцефалический барьер. Однако у больных с гипотиреозом для лечения сопутствующей депрессии недостаточно только назначения комбинированной терапии L-T3 и Ь-Т4 . С другой стороны, у пациентов без нарушения функции щитовидной железы добавление небольших доз L-T3 к стандартной терапии антидепрессантами может быть эффективным.
Классификация рака щитовидной железы (по TNM)
Стадия рака щитовидной железы показывает, насколько распространен опухолевый процесс, как в самой щитовидной железе, так и за ее пределами. Стадия заболевания, помимо морфологической формы рака, важнейший фактор, определяющий выбор лечебной тактики и прогноз заболевания.
Стадирование рака щитовидной железы – стандартизированная система обозначений, разработанная для того, чтобы описать, насколько далеко распространилась опухоль. Наиболее часто используют систему ТNМ, разработанную комитетом AJCC (American Joint Commetteeon Cancer). Система ТNМ описывает, как распространена опухоль в самой щитовидной железе, ее размеры, ограничен ли ее рост только самой щитовидной железой или выходит за ее пределы, распространение опухолевого процесса на окружающие органы и ткани (категория Т), наличие опухолевых клеток в регионарных лимфатических узлах шеи (категория N), и наличие метастазов в отдаленных органах (категория М).
Ниже приведена система стадий рак щитовидной железы согласно руководства от AJCC от 2017 (восьмой пересмотр).
Показатель Т Существует две классификации показателя Т – клиническая и патологоанатомическая. Клиническая классификация основана данных осмотра и результатах ультразвукового исследования и пункционной биопсии. Согласно ей, определяется лечебная тактика и в частности объем операции. Тем не менее, при клинической оценке распространенности опухолевого процесса, часто недооценивается истинная распространенность опухолевого процесса, а более точно стадия определяется после хирургического удаления опухоли по результатам гистологического исследования (патологоанатомическая стадия). Tx – недостаточно данных для оценки первичной опухоли Т0 –опухоль в щитовидной железе не определяется Т1 – опухоль 2 см или меньше в наибольшем измерении, ограниченная тканью щитовидной железы: Т1а — опухоль менее 1 см Т1в – опухоль больше 1, но менее 2 см Т2 – опухоль более 2 см, но не превышает 4 см в наибольшем измерении, ограниченная тканью щитовидной железы Т3 – опухоль более 4 см в наибольшем измерении, ограниченная тканью щитовидной железы, или опухоль любого размера с нвазией за пределы капсулы ЩЖ и прорастанием в грудинощитовидную, грудиноподъязычную, или лопаточноподключичную мышцы Т3а — опухоль более 4 см в наибольшем измерении, ограниченная тканью щитовидной железы Т3в – опухоль любого размера с прорастанием в грудинощитовидную, грудиноподъязычную, или лопаточноподключичную мышцы Т4а – умеренная инвазия: опухоль любого размера, распространяющаяся за пределы капсулы щитовидной железы и прорастающая в мягкие ткани до подкожной клетчатки, в гортань, трахею, пищевод и возвратный гортанный нерв Т4в – широкая инвазия: опухоль врастает в предпозвоночную капсулу. Сонную артерию или сосуды средостения Показатель N Nх – недостаточно данных для оценки регионарных лимфоузлов N0 – клеток рака в регионарных лимфатических узлах нет N1 – имеется поражение регионарных лимфоузлов метастазами. В этом случае выделяют две подгруппы в зависимости от локализации пораженных лимфатических узлов: N1а – поражены лимфоузлы VI группы (паратрахеальные, претрахеальные, преларингеальные (Дельфиана)) – т. е. непосредственно прилежащие к щитовидной железе; N1b – поражены лимфоузлы боковой клетчатки шеи с одной, двух или контрлатеральной стороны (уровни I, II, III, IV, V), ретрофарингеальные
 Рис. 3. Зонирование лимфатических узлов шеи.
Рис. 3. Зонирование лимфатических узлов шеи.
Обмен тиреоидных гормонов
У здорового человека продукция Т4 щитовидной железой составляет около 100 мкг/сут (см. рисунок), продукция Т3 — 30 мкг/сут, из них 20% секретируется щитовидной железой и 80% образуется путем дейодирования Т4 на периферии . Существует 2 типа дейодиназ, обеспечивающих конверсию Т4 в Т3 за счет монодейодирования наружного тирозильного кольца Т4 . Дейодиназы типа 1 (D1) содержатся в основном в периферических тканях (печени, почках, щитовидной железе), а дейодиназы типа 2 (D2) — преимущественно в гипофизе, центральной нервной системе (ЦНС), а также в костях скелета и миокарде . В норме дейодирование Т4 осуществляется преимущественно в печени и почках с участием D1. Многие ткани организма зависят от уровня Т3 в плазме, но в ЦНС наличие D2 обеспечивает поступление Т3 за счет местного дейодирования из Т4 независимо от уровня Т3 в крови. При гипотиреозе активность D1 подавляется, a D2 — повышается и как следствие в ЦНС большее количество Т4 переходит в Т3. В щитовидной железе D1 и D2 за счет интратиреоидной конверсии Т4 в Т3 обеспечивают в условиях гипотиреоза поддержание высокого отношения Т3 к Т4. Известно, что тиреоидные гормоны подавляют активность D2 и повышают D1, поэтому при гипотиреозе основная доля Т3 сыворотки крови обеспечивается за счет активности D2. Следовательно, при сниженном уровне Т4 в сыворотке крови, в гипофизе большее количество Т4 будет переходить в Т3, чем в периферических тканях . Таким образом, экзогенный Т4 эффективно снижает уровень ТТГ, во-первых, за счет конверсии в Т3, во-вторых, он является прогормоном Т3 в тканях гипофиза и ЦНС .
Эти предположения были подтверждены в опытах на животных . Крысам вводили Т4 и Т3, меченные разными изотопами, а затем в препаратах разных тканей оценивали долю ядер- ных рецепторов Т3, связанных с Т3. В гипофизе 78% рецепторов оказались связанными с гормоном, и около половины всего Т3 было образовано путем конверсии из Т4. В печени и почках в связанном виде находилось только около половины ядерных рецепторов Т3, и менее чем в 20% из них Т3 был конвертирован из Т4 .