Буферные системы
Содержание:
Семинар 1. Физическая химия и биохимия.
- Подробности
1. Отличительные свойства живых систем:
Сложность и высокоорганизованностьСтруктурная иерархияСтруктура определяет функциюТрансформация энергииВоспроизводимость и подобие элементов
2. Химия — основа жизни
- Химическая природа биомолекул
- Органическая химия биологических реакций
- Физические законы материи

3. Элементный состав биомолекул
Почему преимущественно Н, C, O и N участвуют в формировании биомолекул?
4. Они обеспечивают многообразие связей и, как следствие, химических стректур и веществ
5. Ковалентные связи в орагических соединений образуют резонансные структуры, которые повышают прочность связей, обеспечивают перераспределение электронной плотности, участвуют в процессах переноса электронов по цепям
6. Высокоэнергетические соединения: макроэргические связи
7. Размеры и величины биоструктур
Органические биомолекулы имеют очень крупные размеры и молекулярный вес
8. Иерархия молекулярной организации биоструктур
Предшественики органических соединений (углекислый газ, вода, мочевина, азот, нитраты) в соединении образуют метаболиты (пируват, цитрат, сукцинат..), которые, в свою очередь, формируют строительные блоки (аминокислоты, моносахариды, жирные кислоты). Из строительных блоков образуются макромолекулы (белки, нуклеиновые кислоты), а они уже образуют супрамолекулярные комплексы (рибосомы, цитоскелет, мультиферментные комплексы). Те, в свою очередь, формируют органеллы клетки и саму клетку в целом
9. Свойства биомолекул отвечают условиям существования и выполняемым функциям
- Полярность и поляризованность
- Носители информации
- Уникальность 3-мерной структуры
- Слабые взаимодействия
Все эти свойства необходимы для поддержания структуры и обеспечения взаимодействий
10. Роль слабых взаимодействий
- Узнавание и функционирование биомолекул за счет структурной комплементарности
- Ограничивают диапазон условий существования ( необходимость катализа)
- Функционирование ферментов
11. Слабые взаимодействия: силы и расстояния
Они играют важную роль в структуре и функции боимолекул
Обратите внимание на расстояния, на которых действуют эти связи и какую силу связи они обеспечивают. Вспомните о водородных связях в молекулах воды и гидрофильных соединениях, ионных взаимодействиях заряженных частиц, гидрофобных связях липидов и жирных кислот. Важны и Ван-дер-Ваальсовы связи, действующие на сверхмалых расстояниях.
Важны и Ван-дер-Ваальсовы связи, действующие на сверхмалых расстояниях.
12. Ван-дер-Ваальсовы взаимодействия
- На очень малых расстояниях
- Быстро ослабевают связи с отдалением молекул друг от друга
- Ван-дер-Ваальсов радиус — это радиус молекулы, на котором проявляются Ван-дер-Ваальсовы взаимодействия, обеспечивает притяжение и оталкивание между молекулами и атомами.
13. Ионные / электростатические взаимодействия
Силы притяжения между противоположно заряженными полярными группировками:
- Не имеют четкой направленности, как у водородных связей
- Нет точного соответствия, как у в-д-в взаимодействий
14. Водородные связи
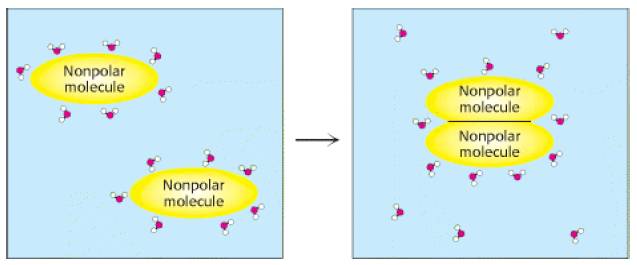
15. Гидрофобные взаимодействия
16. Вода, рН и ионные равновесия
17. Вода как идеальный растворитель
18. Диэлектрическая постоянная
D — мера способности растворителя к дипольным взаимодействиям вокруг ионов и снижения электростатического взаимодействия ионов.
Ионизация молекул вещества в растворе зависит от диэлектрической постоянной растворителя.
19. Гидрофобные взаимодействия
20. Ионизация воды
21. Kw — ионное произведение воды
Вода — слабый элетролит, количество Н+ (Н3О+) или ОН- в 1 литре чистой воды при 25С составляет 10-7 М
22. рН растворов
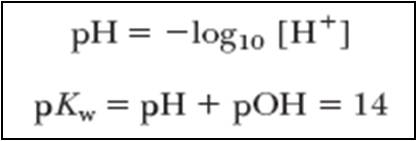
23. Константа диссоциации, сильные и слабые электролиты
24. Уравнение Хендерсона-Хассельбаха
Связывает рН с константой диссоциации и концентрацией ионов в растворе
25. Кривые титрования и буферные системыТитрование — это аналитический метод определения количества кислоты в растворе.
Буферная система состоит из слабой кислоты и ее соли
Линии защиты
У людей и многих других животных кислотно-щелочной гомеостаз поддерживается множеством механизмов, задействованных в трех линиях защиты:
- Химические вещества: первые линии защиты являются немедленными и состоят из различных химических буферов, которые сводят к минимуму изменения pH, которые в противном случае произошли бы в их отсутствие. Эти буферы включают бикарбонатную буферную систему , фосфатную буферную систему и белковую буферную систему.
- Респираторный компонент: Вторая линия защиты — быстрая, состоящая из контроля концентрации углекислоты в ЭКФ путем изменения частоты и глубины дыхания с помощью гипервентиляции или гиповентиляции . Это удаляет или удерживает углекислый газ (и, следовательно, угольную кислоту) в плазме крови по мере необходимости.
- Метаболический компонент: третья линия защиты медленная, лучше всего измеряется избытком оснований и в основном зависит от почечной системы, которая может добавлять или удалять ионы бикарбоната в или из ECF. Ионы бикарбоната образуются из метаболического углекислого газа, который ферментативно превращается в угольную кислоту в клетках почечных канальцев . Там угольная кислота самопроизвольно диссоциирует на ионы водорода и ионы бикарбоната. Когда pH в ECF падает, ионы водорода выводятся с мочой, а ионы бикарбоната выделяются в плазму крови, вызывая повышение pH плазмы. Обратное происходит, если pH в ECF имеет тенденцию повышаться: ионы бикарбоната затем выводятся с мочой, а ионы водорода — в плазму крови.
Вторая и третья линии защиты действуют путем внесения изменений в буферы, каждый из которых состоит из двух компонентов: слабой кислоты и сопряженного с ней основания . Именно отношение концентрации слабой кислоты к ее основанию-конъюгату определяет pH раствора. Таким образом, манипулируя, во-первых, концентрацией слабой кислоты, а во-вторых, концентрацией ее конъюгированного основания, pH внеклеточной жидкости (ECF) можно очень точно отрегулировать до правильного значения. Бикарбонатный буфер, состоящий из смеси угольной кислоты (H 2 CO 3 ) и бикарбоната ( HCO- 3) соль в растворе является самым распространенным буфером во внеклеточной жидкости, а также буфером, в котором отношение кислоты к основанию может быть изменено очень легко и быстро.
Вычисление pH буферной системы
Зона буферирования для пары слабая кислота / сопряженное основание (то есть диапазон pH, в котором такая буферная система может эффективно работать), рассчитывается как pKa±1 .
Отрицательный логарифм константы кислотной диссоциации для угольной кислоты Ka = 3,57 при 37 ° C. При физиологических условиях, концентрация H2CO3 (приблизительно 1 мМ ) существенно ниже, чем концентрация HCO–3 (24-25 мМ), поэтому такая система должна быть очень эффективной в предотвращении снижению pH, но при выделении в кровь щелочных веществ, ее буферная емкость должна быстро исчерпываться. Однако, поскольку кровь постоянно взаимодействует с большой резервной емкостью углекислого газа в воздухе легких, бикарбонатная система может эффективно противостоять и увеличению pH. Реальное наблюдаемое значение pKa в физиологических условиях для нее составляет 6,1.
В клинической медицине для вычисления pH плазмы крови, исходя из концентрации растворенного углекислого газа, используется следующая R03,R03,модификация уравнения Гендерсона-Гассельбаха .
 где p (CO2) выражается в килопаскалях (обычно от 4,6 до 6,7 кПа), а коэффициент 0,23 отражает растворимость углекислого газа в воде.
где p (CO2) выражается в килопаскалях (обычно от 4,6 до 6,7 кПа), а коэффициент 0,23 отражает растворимость углекислого газа в воде.
Карьера
Лоуренс Хендерсон окончил Гарвардский колледж в 1898 году и Гарвардскую медицинскую школу в 1902 году, получив с отличием степень доктора медицины.
Затем последовали два года химических исследований в Страсбургском университете с повышением квалификации в физиологической лаборатории Франца Хофмайстера . Он стал профессором биологической химии, а затем профессором химии в Гарвардском университете, Кембридж, Массачусетс. Его также познакомили с философией и социологией преподаватели Гарвардского университета. Он основал несколько институтов в Гарварде, особенно Гарвардскую лабораторию усталости для физиологических и социологических исследований усталости при поддержке Гарвардской школы бизнеса и Гарвардской медицинской школы , и стал директором. Он служил первым президентом Общества истории науки с 1924-1945 гг.
Хендерсон исследовал кислотно-щелочную регуляцию (1906–2020). Он обнаружил, что кислотно-щелочной баланс регулируется буферными системами крови в сложной координации с дыханием, легкими , эритроцитами и почками . Он написал уравнение Хендерсона в 1908 году, чтобы описать использование угольной кислоты в качестве буферного раствора . Карл Альберт Хассельбалх позже выразил уравнение в логарифмических терминах, создав уравнение Хендерсона – Хассельбаха . Кроме того, он описал транспорт газов крови и общую физиологию крови как физико-химическую систему (1920–1932). Он изобрел и построил новые диаграммы, номограммы с помощью Мориса д’Оканя. Он также ввел номограммы в физиологию и биологию. Последовательная взаимосвязь различных факторов была показана в его книге « Кровь» более чем в ста номограммах.
В 1913 году Хендерсон написал «Пригодность окружающей среды», одну из первых книг, в которых исследуются концепции точной настройки во Вселенной
Хендерсон обсуждает важность воды и окружающей среды по отношению к живым существам, указывая на то, что жизнь полностью зависит от очень специфических условий окружающей среды на Земле, особенно в отношении распространенности и свойств воды. В книге «Пригодность окружающей среды» (1913), которую он написал, мы находим «исследование биологического значения свойств материи» (Хендерсон)
Он видел свойства материи и ход космической эволюции, тесно связанные со структурой живого существа и его деятельностью. Он пришел к выводу: «весь эволюционный процесс, как космический, так и органический, является одним, и теперь биолог может справедливо рассматривать Вселенную по самой своей сути как биоцентрическую».
Как социолог (1932–42) он применил функционализм физиологической регуляции к явлениям социального поведения, основываясь на своей концепции социальных систем . Он описал социальные системы с помощью социологии Вильфредо Парето . В отличие от Парето, Хендерсон применил концепцию социальных систем ко всем дисциплинам, изучающим значения, передаваемые во взаимодействиях между двумя или более людьми, действующими в ролях или ролевых наборах. Хендерсон оказал влияние на многих гарвардских социологов, особенно на Талкотта Парсонса , Джорджа К. Хоманса , Роберта К. Мертона и Элтона Мэйо, которые стали пионерами социологии и психологии. Хендерсон сыграл важную роль в продвижении карьеры Талкотта Парсонса в Гарварде, несмотря на сопротивление Питирима Сорокина . Он также интенсивно обсуждал с Парсонсом методологические главы книги Талкотта Парсонса «Структура социального действия» (1937) в то время, когда Парсонс работал над исходной рукописью.
Исследования Хендерсона зародились и завершились в философском кресле. Несмотря на разнообразие его интересов, его работа в ретроспективе демонстрирует фундаментальное единство; его карьера была в значительной степени посвящена изучению организации организма, вселенной и общества.
Хендерсон был агностиком.
Уравнение Хендерсона-Хассельбальха
Из выражения Ка получено уравнение, которое очень полезно в аналитических расчетах.
Ka = /
Принимая логарифмы,
log Ka = log H+ + журнал A- — log HA
И очистка журнала H+:
-log H = — log Ka + log A- — log HA
Используя затем определения pH и pKa, и термины перегруппировки:
pH = pKa + log (A- / HA)
Это знаменитое уравнение Хендерсона-Хассельбальха.
использование
Уравнение Хендерсона-Хассельбаха используется для оценки pH буферных растворов, а также того, как они влияют на относительные концентрации основания конъюгата и кислоты в pH.
Когда концентрация основания конъюгата равна концентрации кислоты, соотношение между концентрациями обоих слагаемых равно 1; и, следовательно, его логарифм равен 0.
Как следствие, pH = pKa, что очень важно, поскольку в этой ситуации эффективность буфера максимальна.. Обычно берется зона pH, где существует максимальная буферная емкость, где pH = pka ± 1 единица pH. Обычно берется зона pH, где существует максимальная буферная емкость, где pH = pka ± 1 единица pH
Обычно берется зона pH, где существует максимальная буферная емкость, где pH = pka ± 1 единица pH.
В системном кислотно-щелочном балансе
В ткани, клеточное дыхание производит углекислый газ как отходы; как одна из основных ролей сердечно-сосудистая система, большая часть этого CO2 быстро выводится из тканей за счет гидратации до бикарбонат-иона. Бикарбонат-ион, присутствующий в плазме крови, транспортируется в легкие, где обезвоживается обратно в CO.2 и выпускается во время выдоха. Эти преобразования гидратации и обезвоживания CO2 и H2CO3, которые обычно очень медленные, облегчаются карбоангидраза как в крови, так и в двенадцатиперстной кишке. Находясь в крови, ион бикарбоната служит для нейтрализации кислоты, попадающей в кровь в результате других метаболических процессов (например, молочная кислота, кетоновые тела); аналогично, любые базы (например, мочевина от катаболизма белков) нейтрализуются угольной кислотой (H2CO3).
Регулирование
По расчетам Уравнение Хендерсона – Хассельбаха, чтобы поддерживать в крови нормальный pH 7,4 (при этом pKa угольной кислоты составляет 6,1 при физиологической температуре), необходимо постоянно поддерживать соотношение бикарбоната к угольной кислоте 20: 1; это гомеостаз в основном опосредуется датчиками pH в продолговатый мозг мозга и, вероятно, в почки, связанных петлями отрицательной обратной связи с эффекторами в респираторный и почечный системы. В крови большинства животных буферная система бикарбоната связана с легкие через респираторная компенсация, процесс, с помощью которого изменяется частота и / или глубина дыхания, чтобы компенсировать изменения в концентрации CO в крови.2. К Принцип Ле Шателье, выброс CO2 из легких толкает вышеуказанную реакцию влево, в результате чего карбоангидраза образует CO2 пока не будет удалена вся лишняя кислота. Концентрация бикарбоната также регулируется почечная компенсация, процесс, посредством которого почки регулируют концентрацию ионов бикарбоната, секретируя H+ ионы в мочу, в то же время реабсорбируя HCO−3 ионы в плазму крови, или наоборотв зависимости от того, падает или растет pH плазмы соответственно.
Уравнение Хендерсона – Хассельбаха
- pH=пKа ЧАС2CO3+бревно(HCO3−ЧАС2CO3),{displaystyle {ce {pH}} = {extrm {p}} K_ {a ~ {ce {H_2CO_3}}} + log left ({frac {} {}} право),}
куда:
- пKа ЧАС2CO3 отрицательный логарифм (основание 10) числа константа диссоциации кислоты из угольная кислота. Он равен 6,1.
- [HCO−3] — концентрация бикарбонат в крови
- [ЧАС2CO3] — это концентрация угольной кислоты в крови
При описании газ артериальной крови, уравнение Хендерсона – Хассельбаха обычно цитируется в терминах pCO2, то частичное давление из углекислый газ, а не H2CO3. Однако эти величины связаны уравнением:
- ЧАС2CO3=kЧАС CO2×пCO2,{displaystyle = k_ {ce {H ~ CO_ {2}}} imes p_ {ce {CO_ {2}}},}
куда:
- [ЧАС2CO3] — это концентрация угольной кислоты в крови
- kH CO2 — константа, включающая растворимость углекислого газа в крови. kH CO2 примерно 0,03 (ммоль/L)/мм рт. ст.
- пCO2 это частичное давление из углекислый газ в крови
Взятые вместе, следующее уравнение может быть использовано для связи pH крови с концентрацией бикарбоната и парциальным давлением диоксида углерода:
- pH=6.1+бревно(HCO3−0.0307×пCO2),{displaystyle {ce {pH}} = 6,1 + log left ({frac {} {0,0307 imes p _ {{ce {CO_2}}}}} ight),}
куда:
- pH — это кислотность в крови
- [HCO−3] — концентрация бикарбоната в крови, в ммоль/L
- пCO2 парциальное давление углекислого газа в крови в мм рт.
Вывод приближения Кассирера – Блайха.
Уравнение Хендерсона – Хассельбаха, которое выводится из закон массового действия, может быть изменен относительно буферной системы бикарбоната, чтобы получить более простое уравнение, которое обеспечивает быструю аппроксимацию H+ или HCO−3 концентрация без необходимости вычисления логарифмов:
Kа,ЧАС2CO3=HCO3−ЧАС3О+ЧАС2CO3{displaystyle K_ {a, {ce {H_2CO_3}}} = {frac { } {}}}
Поскольку парциальное давление углекислого газа намного легче получить путем измерения, чем парциальное давление угольной кислоты, Константа растворимости закона Генри — который связывает парциальное давление газа с его растворимостью — для CO2 в плазме используется вместо концентрации угольной кислоты. После преобразования уравнения и применения закона Генри уравнение принимает следующий вид:
ЧАС+=K′⋅0.03пCO2HCO3−,{displaystyle = {frac {K’cdot 0.03p _ {{ce {CO_2}}}} {}},}
куда K ’ это константа диссоциации с рKа угольной кислоты, 6,1, что равно 800 нмоль / л (поскольку K ’ = 10−pКа = 10−(6.1) ≈ 8,00X10−07моль / л = 800 нмоль / л).
Умножая K ’ (выражается в нмоль / л) и 0,03 (800 X 0,03 = 24) и перегруппировывается по отношению к HCO−3, уравнение упрощается до:
HCO3−=24пCO2ЧАС+{displaystyle = 24 {frac {p _ {{ce {CO_2}}}} {}}}
Лечение [ править ]
Лечение метаболического ацидоза зависит от первопричины и должно быть направлено на обращение вспять основного процесса
При выборе курса лечения важно различать острую и хроническую формы
Острый метаболический ацидоз править
Бикарбонатная терапия обычно назначается пациентам с тяжелой острой ацидемией (pH <7,11) или с менее тяжелой ацидемией (pH 7,1-7,2) с тяжелым острым повреждением почек. Бикарбонатная терапия не рекомендуется людям с менее тяжелым ацидозом (pH ≥ 7,1), за исключением случаев тяжелого острого повреждения почек. В исследовании BICAR-ICU терапия бикарбонатом для поддержания pH> 7,3 не оказывала общего влияния на комбинированный исход — смертность от всех причин и наличие по крайней мере одного органного отказа на 7-й день. В группе пациентов с тяжелым острым повреждением почек терапия бикарбонатом значительно снизила первичный комбинированный исход и 28-дневную смертность, а также потребность в диализе.
Хронический метаболический ацидоз править
У людей с хроническим заболеванием почек лечение метаболического ацидоза замедляет прогрессирование хронического заболевания почек. Диетические вмешательства для лечения хронического метаболического ацидоза включают индуцирующие основание фрукты и овощи, которые помогают снизить чистую экскрецию кислоты с мочой и увеличить TCO2. Недавние исследования также показали, что ограничение белка в рационе с помощью вегетарианских диет с очень низким содержанием белка, дополненных кетоаналогами, также является безопасным с точки зрения питания вариантом коррекции метаболического ацидоза у людей с хроническим заболеванием почек.
В настоящее время наиболее часто используемым лечением хронического метаболического ацидоза является пероральный прием бикарбоната. Руководства NKF / KDOQI рекомендуют начинать лечение при уровне бикарбоната в сыворотке <22 мэкв / л, чтобы поддерживать уровень ≥ 22 мэкв / л. Исследования, изучающие эффекты пероральной щелочной терапии, продемонстрировали улучшение уровня бикарбоната в сыворотке, что привело к более медленному снижению функции почек и снижению протеинурии, что привело к снижению риска прогрессирования почечной недостаточности. Однако побочные эффекты пероральной щелочной терапии включают непереносимость желудочно-кишечного тракта, усиление отека и усиление артериальной гипертензии. Кроме того, для лечения хронического метаболического ацидоза требуются большие дозы щелочи для перорального применения, а прием таблеток может ограничивать приверженность.
Вевеример (TRC 101) — многообещающий исследуемый препарат, предназначенный для лечения метаболического ацидоза путем связывания с кислотой в желудочно-кишечном тракте и удаления ее из организма через экскрецию с калом, что, в свою очередь, снижает количество кислоты в организме и увеличивает уровень бикарбоната в крови. Результаты фазы 3, двойного слепого плацебо-контролируемого 12-недельного клинического исследования с участием людей с ХБП и метаболическим ацидозом продемонстрировали, что Вевеример эффективно и безопасно скорректировал метаболический ацидоз в краткосрочной перспективе и слепом плацебо-контролируемом исследовании. 40-недельное продление исследования по оценке долгосрочной безопасности продемонстрировало устойчивое улучшение физических функций и комбинированную конечную точку — смерть, диализ или снижение рСКФ на 50%.
Хемиосмотическая модель
Полярный транспорт ауксина (PAT) — это направленный и активный поток молекул ауксина через ткани растения. Поток молекул ауксина через соседние клетки управляется переносчиками ( типом мембранного транспортного белка ) от клетки к клетке (от одной клетки к другой клетке, а затем к следующей), и направление потока определяется локализацией носителей на плазматической мембране в затронутых клетках.
Транспортировка от ячейки к соседней достигается за счет относительно сложной комбинации нескольких подпроцессов. Чтобы объяснить механизм, лежащий в основе уникального характера транспорта ауксина через файлы живых клеток растения, была сформулирована так называемая хемиосмотическая модель . Механизм был впервые предложен в семидесятых годах Рубери и Шелдрейком, и это дальновидное предсказание было окончательно подтверждено в 21 веке.
Механизм, приведенный ниже, описывает процесс, в котором ауксин захватывается в клетке так называемой кислотной ловушкой, и как он может затем покинуть клетку только за счет активности определенных носителей, которые контролируют направленность потока из клеток и, как правило, направление транспорт ауксина через все тело растения.
Кислотная ловушка
Пассивная диффузия на клеточной мембране. Тем не мение; в случае ауксинов только недиссоциированная часть молекул ауксина может пересекать мембрану
Поскольку ауксины являются слабыми кислотами, их протонирование определяется pH окружающей среды; сильнокислая среда подавляет прямую реакцию ( диссоциацию ), тогда как щелочная среда сильно способствует ей (см. уравнение Хендерсона-Хассельбаха ):
Экспорт ауксинов из клеток называется оттоком ауксина, а поступление ауксина в клетки называется притоком ауксина . Первым шагом в полярном транспорте является приток ауксина. Ауксин проникает в клетки растений двумя способами, во-первых, путем пассивной диффузии в виде неионизированной протонированной индол-3-уксусной кислоты (ИУКК) через фосфолипидный бислой , а во-вторых, путем активного совместного транспорта в анионной форме ИУК — . Поскольку IAAH является липофильным, она может легко проходить через липидный бислой.
-
- ⇌ , где = индол-3-уксусная кислота; = его сопряженное основание
Внутренняя часть клеток (pH ~ 7) менее кислая, чем снаружи ( апопласт ; pH ~ 5,5). Таким образом, вне клетки значительная часть (17%) молекул ИУК остается недиссоциированной (ассоциированной с протонами). Эта часть ауксина молекул заряда -нейтрального и , следовательно , он способен диффундировать через липофильный липидный бислой (липидный бислой является составной частью клеточной мембраны ) в клетки . Пройдя через бислой в клетке, молекулы подвергаются воздействию более основного pH внутри клетки, и там они почти полностью диссоциируют, образуя анионную ИУК — . Эти химически полярные ионы не могут пассивно диффундировать через клеточную мембрану и оставаться в ловушке внутри клетки.
Полярность экспорта ауксина
Попав внутрь клетки, ауксин не может покинуть клетку самостоятельно, пересекая липидный бислой. Следовательно, для экспорта ауксина из клетки требуется активный транспортный компонент в плазматической мембране, то есть некоторый мембранный транспортный белок . Два семейства белков: переносчики белков PIN и ABCB ( белки PGP ) действуют как « переносчики оттока ауксина » и транспортируют анионную форму ауксина из клетки. В то время как переносчики оттока ауксина PGP равномерно распределены, белки PIN обычно поддерживают полярную (т.е. асимметричную) локализацию на плазматической мембране. То есть они больше всего сконцентрированы на одной стороне клетки. Более того, асимметричная локализация белков PIN координируется между соседними клетками. В результате белки PIN генерируют направленный поток ауксина в тканях и органах. Этот поток, генерируемый PIN, называется полярным транспортом ауксина. Например, все клетки, расположенные в сосудистой сети (в центре) корня, обнаруживают белки PIN1 только на своей базальной мембране (т.е. на их нижней стороне). В результате в сосудистой сети корня ауксин направляется от побега к верхушке корня (то есть вниз).






