Клиренс в медицине
Содержание:
Биотрансформация
В неизменном виде выделются лишь высокогидрофильные ионизированные соединения, средства для ингаляционного наркоза.
Биотрансформация большинства веществ происходит в печени, где обычно создаются высокие концентрации веществ. Кроме того, может происходить биотрансформация в легких, почках, стенке кишечника, коже и т.д.
Различают два основных вида биотрансформации:
1) метаболическая трансформация
Превращение веществ за счет окисления, восстановления и гидролиза. Окисление происходит, в основном, за счет микросомальных оксидаз смешанного действия при участии НАДФ, кислорода и цитохрома Р-450. Восстановление происходит под влиянием системы нитро- и азоредуктаз и т.п. Гидролизируют, обычно, эстерзы, карбоксилэстеразы, амидазы, фосфатазы и т.д.
Метаболиты, как правило, менее активны, чем исходные вещества, но иногда активнее них. Например: эналаприл метаболизируется в энаприлат, который оказывает выраженное гипотензивное действие. Однако, он плохо всасывается в ЖКТ, потому стараются вводить в/в.
Метаболиты могут быть токсичнее исходных веществ. Метаболит парацетамола – N-ацетил-пара-бензохинонимин при передозировке вызывает некроз печени.
2) конъюгация
Биосинтетический процесс, сопровождающийся присоединением к лекарственному веществу или его метаболитам ряда химических группировок или молекул эндогенных соединений.
Процессы идут либо один за другим, либо протекают отдельно!
Различают также:
-специфическую биотрансформацию
Отдельный фермент воздействует на одно или несколько соединений, проявляя при этом высокую субстратную активность. Пример: метиловый спирт окисляется алкогольдегидрогеназой с образованием формальдегидом и муравьиной кислоты. Этиловый спирт также окисляется аклогольдегидрогеназой, но аффинитет этанола к ферменту значительно выше, чем у метанола. Поэтому этанол может замедлять биотрансформацию метанола и уменьшать его токсичность.
-неспецифическую биотрансформацию
Под влиянием микросомальных ферментов печени (в основном, оксидазы смешанных функций), локализованных в гладкоповерхностных участках эндоплазматического ретикулума клеток печени.
В результате биотрансформации липофильные незаряженные вещества обычно превращаются в гидрофильные заряженные, поэтому легко выводятся из организма.
Биодоступность. Пресистемная элиминация.
В связи с тем, что системное действие вещества развиваеся только при попадании его в кровоток, откуда оно поступает в ткани, предложен термин «биодоступность».
В печени многие вещества подвергаются биотрансформации. Частично вещество может выделяться в кишечник с желчью. Именно поэтому в кровь может попасть лишь часть вводимого вещества, остальная часть подвергается элиминации при первом прохождении через печень.
Элиминация – биотрансформация + экскреция
Кроме того, лекарства могут не полностью всасываться в кишечнике, подвергаться метаболизму в стенке кишечника, частично выводиться из него. Все это, вместе с элиминацией при первом прохождении через печень называют пресистемной элиминацией.
Биодоступность – количество неизмененного вещества, попавшего в общий кровоток, в процентном отношении к введенному количеству.
Как правило, в справочниках указано значения биодоступности при их назначении внутрь. Например, биодоступность пропранолола – 30%. Это означает, что при введении внутрь в дозе 0.01 (10 мг) только 0,003 (3 мг) неизмененного пропранолола попадает в кровь.
Для определения биодоступности лекарство вводят в вену (при в/в способе введения биодоступность вещества составляет 100%). Через определенные интервалы времени определяются концентрации вещества в плазме крови, затем строят кривую изменения концентрации вещества во времени. Затем ту же дозу вещества назначают внутрь, определяют концентрацию вещества в крови и также строят кривую. Измеряют площади под кривыми – AUC. Биодоступность – F – определяют как отношение AUC при назначении внутрь к AUC при внутревенном введении и обозначают в процентах.
Распределение лекарственных веществ.
При попадании в кровоток липофильные вещества, как правило, распределяются в организме относительно равномерно, а гидрофильные полярные – неравномерно.
Существенное влияние на характер распределения веществ оказывают биологические барьеры, которые встречаются у них на пути: стенки капилляров, клеточные и плазматические мембраны, гемато-энцефалический и плацентарный барьеры (уместно посмотреть раздел «Фильтрафия через межклеточные промежутки»).
-ГЭБ
Эндотелий капилляров мозга не имеет пор, там практически отсутствует пиноцитоз. Также роль играют астроглии, которые увеличивают барьерную силу.
-гематоофтальмический барьер
Препятствует проникновению гидрофильных полярных веществ из крови в ткань глаза.
-плацентарный
Препятствует проникновению гидрофильных полярных веществ из организма матери в организм плода.
Для характеристики распределения лекарственного вещества в системе однокамерной фармакокинетической модели (организм условно представляется как единое пространство, заполненное жидкостью. При введении лекарственное вещество мгновенно и равномерно распределяется) используют такой показатель как кажущийся объем распределения — Vd
Кажущийся объем распределения отражает предположительный объем жидкости, в котором распределяется вещество.
Если для лекарственного вещества Vd= 3 л (объем плазмы крови), то это означает, что вещество находится в плазме крови, не проникает в форменные элементы крови и невыходит за пределы кровеносного русла. Возможно, это высокомолекулярное вещество (Vd для гепарина = 4 л).
Vd= 15 л означает, что вещество находится в плазме крови (3 л), в межклеточной жидкости (12 л ) и не проникает в клетки тканей. Вероятно, это гидрофильное полярное вещество.
Vd= 400 – 600 – 1000л означает, что ещество депонировано в периферических тканях и его концентрация в крови низкая. Например, для имипрамина – трициклический антидепрессант — Vd= 23л/кг, то есть примерно 1600 л. Это означает, что концентрация имипрамина в крови очень низкая и при отравлении имипрамином гемодиализ неэффективен.
Список литературы
1. Nolin T.D., Ouseph R., Himmelfarb J., McMenamin M.E. and Ward R.A. Multiple-Dose Pharmacokinetics and Pharmacodynamics of N-Acetylcysteine in Patients with End-Stage Renal Disease. Clin J Am. Soc Nephrol. 2010; 5: 1588-1594.
2. Kelly G.S. Clinical Applications of N-acetylcysteine. Alt Med Rev. 1998; 3 (2): 114-127.
3. Cacciatore I., Cornacchia C., Pinnen F., Mollica A and Di Stefano A. Prodrug Approach for Increasing Cellular Glutathione Levels (review). Molecules. 2010; 15: 1242-1264.
4. De Caro L., Ghizzi A., Costa R., Longo A., Ventresca Lodola E. Pharmacokinetics and bioavailability of oral acetylcysteine in healthy volunteers. Arzneim Forsch Drug Res. 1989; 39: 382-386.
5. Wu G., Fang Y.-Z., Yang S., Lupton J.R. and Turner N.D. Glutathione Metabolism and Its Implications for Health (review). J. Nutr. 2004; 134: 489-492.
6. Townsend D.M., Tew K.D., Tapiero H. The importance of glutathione in human disease. Biomedicine & Pharmacotherapy. 2003; 57: 145-155.
7. Olsson B., Johansson M., Gabrielsson J., Bolme P. Pharmacokinetics and bioavailability of reduced and oxidized N-acetylcysteine. Eur J Clin Pharmacol. 1988; 34 (1): 77-82.
8. Borgstrom L., Kagedal B., Paulsen O. Pharmacokinetics of N-acetylcysteine in man. Eur J Clin Pharmacol. 1986; 31 (2): 217-222.
9. Jones A.L., Jarvie D. R., Simpson D., Hayes P.C. and Prescott L. F. Pharmacokinetics of N-acetylcysteine are altered in patients with chronic liver disease. Aliment Pharmacol Ther. 1997; 11: 787-791.
10. Hong S-Y, Gil H-W, Yang J-O, Lee E-Y, Kim H-K, Kim S-Het al. Effect of High-Dose Intravenous N-acetylcysteine on the Concentration of Plasma Sulfur-Containing Amino Acids. The Korean Journal of Internal Medicine. 2005; 20: 217-223.
11. Дутов А.А. Биомедицинская хроматография. М.: Гэотар-медиа, 2016; 312.
12. Сергиенко В.И., Джеллифф Р., Бондарева И.Б. Прикладная фармакокинетика: основные положения и клиническое применение. М.: Издательство РАМН, 2003; 208.
13. Holdiness M.R. Clinical pharmacokinetics of N-acetylcysteine. Clin Pharmacokinet. 1991; 20 (2): 123-134.
14. Tsikas D., Sandmann J., Ikic M., Fauler J., Stichtenoth D. O., Frölich J.C. Analysis of cysteine and N-acetylcysteine in human plasma by high-performance liquid chromatography at the basal state and after oral administration of N-acetylcysteine. Journal of Chromatography B. 1988; 708: 55-60.
15. Burgunder J.M., Varriale A., and Lauterburg B.H. Effect of N-acetylcysteine on plasma cysteine and glutathione following paracetamol administration. Eur J Clin Pharmacol. 1989; 36: 127-131.
16. Bridgeman M.E., Marsden M., Selby C., Morrison D., MacNee W. Effect of N-acetyl cysteine on the concentrations of thiols in plasma, bronchoalveolar lavage fluid, and lung tissue. Thorax. 1994; 49: 670-675.
17. Jones D.P. Redox potential of GSH/GSSG couple: assay and biological significance. Methods Enzymol. 2002; 348: 93-112.
18. Lomaestro, B.M., Malone M. Glutathione in health and disease: pharmacotherapeutic issues. Annals Pharmacother. 1995; 29: 1263-1273.
19. Samiec P.S., Drews-Botsch C., Flagg E.W., Kurtz J.C., Sternberg P., Reed R.L., Jones D.P. Glutathione in human plasma: decline in association with aging, age-related macular degeneration, and diabetes. Free Radic Biol Med. 1998; 24: 699-704.
20. Anderson M.E., Nilsson M., Eriksson P.S., Sims N.R. Glutathione monoethyl ester provides neuroprotection in a rat model of stroke. Neurosci Lett. 2004; 354: 163-165,
21. Anderson M.E., Nilsson M., Sims N.R. Glutathione monoethyl ester prevent mitochondrial glutathione depletion during focal cerebral ischemia. Neurochem Int. 2004; 44: 153-159.
Механизмы всасывания веществ
Лекарственные вещества могут проникать в клетку путем:
— пассивной диффузии
В мембране есть аквапорины, через которые поступает вода в клетку и могут проходить путем пассивной диффузии по градиенту концентрации растворенные в воде гидрофильные полярные вещества с очень малыми размерами молекул (эти аквапорины очень узкие). Однако, такой тип поступления лекарственных веществ в клетке очень редок, так как размер большинства молекул лекарственных веществ превышает размер диаметр аквапоринов.
Также путем простой диффузии проникают липофильные неполярные вещества.
— активного транспорта
Транспорт лекарственного гидрофильного полярного вещества через мембрану против градиента концентрации с помощью специального переносчика. Такой транспорт избирателен, насыщаем и требует затрат энергии.
Лекарственное вещество, имеющее аффинитет к транспортному белку, соединяется с местами связывания этого переносчика с одной стороны мембраны, затем происходит конформационное изменение переносчика, и, наконец, вещество высвобождается с другой стороны мембраны.
— облегченной диффузии
Транспорт гидрофильного полярного вещества через мембрану специальной транспортной системой по градиенту концентрации, без затрат энергии.
— пиноцитоза
Впячивания клеточной мембраны, окружающие молекулы вещества и образующие везикулы, которые проходят через цитоплазму клетки и высвобождают вещество с другой стороны клетки.
— фильтрации
Через поры мембран.
Также имеет значение фильтрация лекарственных веществ через межклеточные промежутки.
Фильтрация ГПВ через межклеточные промежутки имеет важное значение при всасывании, распределении и выведении и зависит от:
а) величины межклеточных промежутков
б) величины молекул веществ
Примеры:
1) через промежутки между клетками эндотелия в капиллярах почечных клубочков путем фильтрации легко проходят большинство лекарственных веществ, находящихся в плазме крови, если они не связаны с белками плазмы.
2) в капиллярах и венулах подкожно-жировой клетчатки, скелетных мышц промежутки между клетками эндотелия достаточны для прохождения большинства лекарственных веществ. Поэтому при введении под кожу или в мышцы хорошо всасываются и проникают в кровь и липофильные неполярные вещества (путем пассивной диффузии в липидной фазе), и гидрофильные полярные (путем фильтрации и пассивной диффузии в водной фазе через промежутки между клетками эндотелия).
3) при введении ГПВ в кровь вещества быстро проникают в большинство тканей через промежутки между эндотелиоцитами капилляров. Исключения вещества, для которых существуют системы активного транспорта (противопаркинсонический препарат левадопа) и ткани, отделенные от крови гистогематическими барьерами. Гидрофильные полярные вещества могут проникнуть через такие барьеры только в некоторых местах, в которых барьер мало выражен (в area postrema продолговатого мозга проникают ГПВ в триггер-зону рвотного центра).
Липофильные неполярные вещества легко проникают в центральную нервную системы через гемато-энцефалический барьер путем пассивной диффузии.
4) В эпителии ЖКТ межклеточные промежутки малы, поэтому ГПВ достаточно плохо всасываются в нем. Так, гидрофильное полярное вещество неостигмин под кожу назначают в дозе 0,0005 г, а для получения сходноого эффекта при назначении внутрь требуется доза 0,015 г.
Липофильные неполярные вещества легко всасываются в ЖКТ путем пассивной диффузии.
Биодоступность
Различные формы таблеток, которые будут иметь разное фармакокинетическое поведение после приема.
На практическом уровне биодоступность лекарства можно определить как долю лекарства, которая достигает места своего действия. С этой точки зрения внутривенное введение лекарства обеспечивает максимально возможную биодоступность, и считается, что этот метод дает биодоступность, равную 1 (или 100%). Биодоступность других методов доставки сравнивается с биодоступностью внутривенной инъекции (абсолютная биодоступность) или со стандартным значением, относящимся к другим методам доставки в конкретном исследовании (относительная биодоступность).
- BАзнак равноАBCп⋅DяVАBCяV⋅Dп{\ displaystyle B_ {A} = {\ frac { _ {P} \ cdot D_ {IV}} { _ {IV} \ cdot D_ {P}}}}
- Bрзнак равноАBCА⋅дозаBАBCB⋅дозаА{\ displaystyle {\ mathit {B}} _ {R} = {\ frac { _ {A} \ cdot {\ text {доза}} _ {B}} { _ {B} \ cdot {\ text {доза}} _ {A}}}}
После того, как биодоступность лекарственного средства установлена, можно рассчитать изменения, которые необходимо внести в его дозировку, чтобы достичь требуемых уровней в плазме крови. Следовательно, биодоступность — это математический фактор для каждого отдельного лекарства, который влияет на вводимую дозу. Можно рассчитать количество лекарственного средства в плазме крови, которое имеет реальный потенциал вызвать свой эффект, используя формулу:
- Dезнак равноB⋅Dа{\ Displaystyle De = B \ cdot Da \,}
где De — эффективная доза , биодоступность B и введенная доза Da .
Следовательно, если лекарство имеет биодоступность 0,8 (или 80%) и его вводят в дозе 100 мг, уравнение покажет следующее:
- Де = 0,8 × 100 мг = 80 мг
То есть введенные 100 мг представляют собой концентрацию в плазме крови 80 мг, которая обладает способностью оказывать фармацевтический эффект.
Эта концепция зависит от ряда факторов, присущих каждому лекарству, таких как:
- Форма выпуска
- Химическая форма
- Путь введения
- Стабильность
- Метаболизм
Эти концепции, которые подробно обсуждаются в соответствующих статьях, могут быть математически определены количественно и интегрированы для получения общего математического уравнения:
- Dезнак равноQ⋅Dа⋅B{\ Displaystyle De = Q \ cdot Da \ cdot B \,}
где Q — чистота препарата.
- Vазнак равноDа⋅B⋅Qτ{\ displaystyle Va = {\ frac {Da \ cdot B \ cdot Q} {\ tau}}}
где — скорость введения лекарственного средства, а — скорость, с которой абсорбированное лекарственное средство достигает кровеносной системы.
Vа{\ displaystyle Va}τ{\ Displaystyle \ тау}
Наконец, используя уравнение Хендерсона-Хассельбаха и зная значения лекарственного средства ( pH, при котором существует равновесие между его ионизированными и неионизированными молекулами), можно рассчитать неионизированную концентрацию лекарственного средства и, следовательно, концентрацию, которая будет подвергаться воздействию. к абсорбции:
пKа{\ displaystyle pKa \,}
- пЧАСзнак равнопKа+бревноBА{\ displaystyle \ mathrm {pH} = \ mathrm {pKa} + \ log {\ frac {B} {A}}}
Когда два препарата имеют одинаковую биодоступность, они считаются биологическими эквивалентами или биоэквивалентами. Эта концепция биоэквивалентности важна, поскольку в настоящее время она используется в качестве критерия при выдаче разрешений на генерические препараты во многих странах.
Обзор
Фармакокинетика описывает, как организм влияет на конкретный ксенобиотик / химическое вещество после введения через механизмы абсорбции и распределения, а также метаболические изменения вещества в организме (например, метаболические ферменты, такие как цитохром P450 или ферменты глюкуронозилтрансферазы ), и эффекты и пути выведения метаболитов препарата. Фармакокинетические свойства химических веществ зависят от способа введения и дозы введенного препарата. Это может повлиять на скорость всасывания.
Темы фармакокинетики
Модели были разработаны, чтобы упростить концептуальное представление многих процессов, которые происходят во взаимодействии между организмом и химическим веществом. Одна из них, , является наиболее часто используемым приближением к реальности; однако сложность, связанная с добавлением параметров при таком подходе к моделированию, означает, что наиболее часто используются однокомпонентные модели и, прежде всего, две компартментные модели . Различные части, на которые подразделяется модель, обычно называют схемой ADME (также называемой LADME, если высвобождение включено в качестве отдельного этапа от абсорбции):
- Л iberation- процесс высвобождения лекарственного средства изфармацевтического препарата. См. ТакжеIVIVC.
- Bsorption- процесс веществапоступающего в кровообращение.
- D istribution- дисперсия или распространение веществвсей жидкости и ткани организма.
- М etabolism(или биотрансформация, или инактивация) — признание организмачто инородное вещество присутствует и необратимое превращение исходных соединений в дочерние метаболиты.
- Е xcretion- удаление веществ из организма. В редких случаях некоторыелекарстванеобратимо накапливаются втканях организма.
Две фазы метаболизма и выведения также можно сгруппировать под названием «устранение». Изучение этих отдельных фаз включает использование основных понятий и манипулирование ими для понимания динамики процесса. По этой причине, чтобы полностью понять кинетику лекарственного средства, необходимо иметь подробные знания о ряде факторов, таких как: свойства веществ, которые действуют как вспомогательные вещества , характеристики соответствующих биологических мембран и способ, которым вещества могут пересекать их, или особенности ферментативных реакций , инактивирующих препарат.
Все эти концепции могут быть представлены с помощью математических формул , имеющих соответствующее графическое представление . Использование этих моделей позволяет понять характеристики молекулы , а также то, как конкретное лекарство будет вести себя, учитывая информацию о некоторых из его основных характеристик, таких как константа кислотной диссоциации (pKa), биодоступность и растворимость , абсорбционная способность и распределение. в организме.
Результаты модели для лекарственного средства могут использоваться в промышленности (например, при расчете биоэквивалентности при разработке генерических лекарственных средств) или в клиническом применении фармакокинетических концепций. Клиническая фармакокинетика содержит множество руководств по эффективному и действенному использованию лекарств для медицинских работников и в ветеринарии .
Клиническая фармакокинетика
|
Противоэпилептический
медикамент |
Кардиоактивный
медикамент |
Иммунодепрессор
медикамент |
Антибиотик
медикамент |
|---|---|---|---|
|
|
|
|
|
Бронходилататор
медикамент |
Цитостатический
медикамент |
Противовирусное средство
(ВИЧ) лекарства |
Факторы свертывания |
|
+ Эфавиренц
|
|
Клиническая фармакокинетика (возникающая в результате клинического использования фармакокинетики населения) — это прямое применение к терапевтической ситуации знаний о фармакокинетике лекарственного средства и характеристиках популяции, к которой принадлежит (или может быть отнесен) пациент.
Примером может служить возобновление использования циклоспорина в качестве иммуносупрессора для облегчения трансплантации органов. Первоначально были продемонстрированы терапевтические свойства препарата, но его почти никогда не использовали после того, как было обнаружено, что у ряда пациентов он вызывает нефротоксичность . Однако затем стало понятно, что можно индивидуализировать дозу циклоспорина пациенту, анализируя плазматические концентрации пациентов (фармакокинетический мониторинг). Эта практика позволила снова использовать этот препарат и облегчила большое количество трансплантаций органов.
Клинический мониторинг обычно осуществляется путем определения концентраций в плазме, поскольку эти данные обычно легче всего получить и они наиболее надежны. К основным причинам определения концентрации препарата в плазме крови относятся:
- Узкий терапевтический диапазон (разница между токсической и терапевтической концентрациями)
- Высокая токсичность
- Высокий риск для жизни.
Фармакокинетика населения
Фармакокинетика населения — это исследование источников и коррелятов вариабельности концентраций лекарственного средства среди лиц, которые являются целевой популяцией пациентов, получающих клинически значимые дозы интересующего лекарственного средства. Определенные демографические, патофизиологические и терапевтические особенности пациента, такие как масса тела, выделительные и метаболические функции, а также наличие других методов лечения, могут регулярно изменять зависимости концентрации от дозы и могут объяснять вариабельность воздействия. Например, стационарные концентрации лекарств, выводимых в основном почками, обычно выше у пациентов, страдающих почечной недостаточностью, чем у пациентов с нормальной функцией почек, получающих ту же дозу лекарства. Популяционная фармакокинетика направлена на выявление поддающихся измерению патофизиологических факторов и объяснение источников вариабельности, которые вызывают изменения во взаимосвязи между дозой и концентрацией и степенью этих изменений, так что, если такие изменения связаны с клинически значимыми и значительными изменениями в экспозициях, которые влияют на терапевтический индекс , дозировка может быть изменена соответствующим образом. Преимуществом популяционного фармакокинетического моделирования является его способность анализировать разреженные наборы данных (иногда доступно только одно измерение концентрации для каждого пациента).
Определение
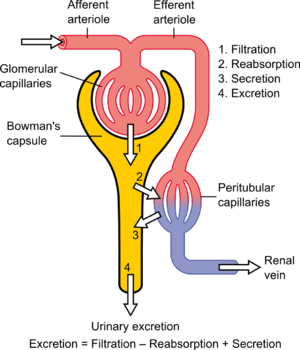
Диаграмма, показывающая основные физиологические механизмы почек
Что касается функции почек , клиренсом считается количество жидкости, отфильтрованной из крови, которая обрабатывается почками, или количество крови, очищаемой за раз, поскольку она имеет единицы объемного расхода . Однако это не относится к реальной стоимости; «почка не удаляет полностью вещество из общего почечного плазменного потока». С точки зрения массопереноса и физиологически объемный кровоток (к диализному аппарату и / или почкам) является лишь одним из нескольких факторов, которые определяют концентрацию в крови и удаление вещества из организма. Другие факторы включают в себя коэффициент переноса массы , поток диализата и диализат поток рециркуляции для гемодиализа, а также скорость клубочковой фильтрации и трубчатые скорости реабсорбции, для почек. Физиологическая интерпретация клиренса (в установившемся состоянии) заключается в том, что клиренс — это соотношение образования массы и концентрации в крови (или плазме ) .
Его определение следует из дифференциального уравнения, которое описывает экспоненциальный распад и используется для моделирования функции почек и функции аппарата гемодиализа :
-
VdCdтзнак равно-K⋅C+м˙{\ displaystyle V {\ frac {dC} {dt}} = — K \ cdot C + {\ dot {m}}} ( 1 )
Где:
- м˙{\ displaystyle {\ dot {m}}} — массовая скорость образования вещества, принимаемая за константу, т. е. не зависящую от времени (равная нулю для посторонних веществ / лекарств) [ммоль / мин] или [моль / с]
- t — время диализа или время с момента инъекции вещества / лекарства или
- V — объем распределения или общая вода в организме или
- K — зазор [мл / мин] или [м 3 / с]
- C — концентрация [ммоль / л] или [моль / м 3 ] (в США часто [мг / мл])
Из приведенных выше определений следует, что это первая производная концентрации по времени, то есть изменение концентрации во времени.
dCdт{\ displaystyle {\ frac {dC} {dt}}}
Он выводится из баланса масс.
Клиренс вещества иногда выражается как величина, обратная постоянной времени, которая описывает скорость его удаления из организма, деленную на его объем распределения (или общую воду в организме ).
В установившемся режиме он определяется как скорость образования массы вещества (равная скорости удаления массы), деленная на его концентрацию в крови .
Клиренс, период полураспада и объем распределения
Существует важная взаимосвязь между клиренсом, периодом полувыведения и объемом распределения
Константа скорости выведения лекарственного средства el эквивалентна полному клиренсу, деленному на объем распределения (el = Cltot / Vd) (обратите внимание на использование Cl, а не, не путать с el). Но el также эквивалентен ln2, деленному на период полувыведения t1 / 2 (Κel = ln2t1 / 2)
Таким образом, Cltot = ln2 Vd / t1 / 2. Это означает, например, что увеличение общего клиренса приводит к уменьшению периода полувыведения, при условии, что объем распределения постоянен. Вывод этих уравнений можно найти, например, в «Фармакологии Рэнга и Дейла».
Депонирование
При распределении лекарственного вещества в организме часть может задерживаться (депонироваться) в различных тканях. Из депо вещество высвобождается в кровь и оказывает фармакологическое действие.
1) Липофильные вещества могут депонироваться в жировой ткани. Средство для наркоза тиопентал-натрий вызывает наркоз продолжительнотью 15-20 минут, так как 90% тиопентала-натрия депонируется в жировой ткани. После прекращения наркоза наступает посленаркозный сон 2-3 часа в связи с высвобождением тиопентала-натрия.
2) Тетрациклины на длительное время депонируются в костной ткани. Поэтому не назначают детям до 8 лет, так как может нарушить развитие костей.
3) Депонирование, связанное с плазмой крови. В соединении с белками плазмы вещества не проявляют фармакологической активности.
Анализ
Биоаналитические методы
Для построения профиля «концентрация-время» необходимы биоаналитические методы . Химические методы используются для измерения концентрации лекарств в биологической матрице , чаще всего в плазме. Правильные биоаналитические методы должны быть избирательными и чувствительными. Например, термофорез на микромасштабах можно использовать для количественной оценки того, как биологическая матрица / жидкость влияет на сродство лекарственного средства к его мишени.
Масс-спектрометрии
Фармакокинетику часто изучают с помощью масс-спектрометрии из-за сложной природы матрицы (часто плазмы или мочи) и необходимости высокой чувствительности для наблюдения концентраций после низкой дозы и в течение длительного периода времени. Наиболее распространенным оборудованием, используемым в этом приложении, является ЖХ-МС с тройным квадрупольным масс-спектрометром . Для дополнительной специфичности обычно используется тандемная масс-спектрометрия . Стандартные кривые и внутренние стандарты обычно используются для количественного определения одного фармацевтического препарата в образцах. Образцы представляют разные моменты времени, когда лекарство вводится, а затем метаболизируется или выводится из организма. Холостые пробы, взятые перед введением, важны для определения фона и обеспечения целостности данных с такими сложными матрицами проб
Большое внимание уделяется линейности стандартной кривой; однако обычно используют аппроксимацию кривой с более сложными функциями, такими как квадратичные, поскольку отклик большинства масс-спектрометров не является линейным в больших диапазонах концентраций.
В настоящее время существует значительный интерес к использованию масс-спектрометрии с очень высокой чувствительностью для исследований микродозирования , которые рассматриваются как многообещающая альтернатива экспериментам на животных . Недавние исследования показывают, что вторичная ионизация электрораспылением (SESI-MS) может использоваться для мониторинга лекарств, что дает преимущество в предотвращении жертвоприношения животных.
Вывод уравнения
Уравнение выводится из баланса масс :
-
Δмтелознак равно(-м˙вне+м˙в+м˙ген.)Δт{\ displaystyle \ Delta m _ {\ text {body}} = (- {\ dot {m}} _ {\ text {out}} + {\ dot {m}} _ {\ text {in}} + {\ точка {m}} _ {\ text {gen.}}) \ Delta t} ( 2 )
где:
- Δт{\ displaystyle \ Delta t} это период времени
- Δмтело{\ displaystyle \ Delta m _ {\ text {body}}} изменение массы токсина в организме во время Δт{\ displaystyle \ Delta t}
- м˙в{\ displaystyle {\ dot {m}} _ {\ text {in}}} скорость поступления токсина
- м˙вне{\ displaystyle {\ dot {m}} _ {\ text {out}}} скорость удаления токсина
- м˙ген.{\ displaystyle {\ dot {m}} _ {\ text {gen.}}} скорость образования токсина
Проще говоря, приведенное выше уравнение гласит:
- Изменение массы токсина в организме ( ) в течение некоторого времени равно потреблению токсина плюс образование токсина минус удаление токсина.Δм{\ displaystyle \ Delta m}Δт{\ displaystyle \ Delta t}
С
-
мтелознак равноC⋅V{\ displaystyle m _ {\ text {body}} = C \ cdot V} ( 3 )
а также
-
м˙внезнак равноK⋅C{\ displaystyle {\ dot {m}} _ {\ text {out}} = K \ cdot C} ( 4 )
Уравнение A1 можно переписать как:
-
Δ(C⋅V)знак равно(-K⋅C+м˙в+м˙ген.)Δт{\ displaystyle \ Delta (C \ cdot V) = \ left (-K \ cdot C + {\ dot {m}} _ {\ text {in}} + {\ dot {m}} _ {\ text {gen. }} \ right) \ Delta t} ( 5 )
Если один комочки в и ген. слагаемые вместе, т. е. и деление на результат представляет собой разностное уравнение :
м˙знак равном˙в+м˙ген.{\ displaystyle {\ dot {m}} = {\ dot {m}} _ {\ text {in}} + {\ dot {m}} _ {\ text {gen.}}}Δт{\ displaystyle \ Delta t}
-
Δ(C⋅V)Δтзнак равно-K⋅C+м˙{\ displaystyle {\ frac {\ Delta (C \ cdot V)} {\ Delta t}} = — K \ cdot C + {\ dot {m}}} ( 6 )
Если применить предел, получится дифференциальное уравнение:
Δт→{\ displaystyle \ Delta t \ to 0}
-
d(C⋅V)dтзнак равно-K⋅C+м˙{\ displaystyle {\ frac {d (C \ cdot V)} {dt}} = — K \ cdot C + {\ dot {m}}} ( 7 )
Используя правило продукта, это можно переписать как:
-
CdVdт+VdCdтзнак равно-K⋅C+м˙{\ displaystyle C {\ frac {dV} {dt}} + V {\ frac {dC} {dt}} = — K \ cdot C + {\ dot {m}}} ( 8 )
Если предположить, что изменение объема незначительно, то есть результатом будет уравнение :
CdVdтзнак равно{\ displaystyle C {\ frac {dV} {dt}} = 0}








