Четвертичная структура белков
Содержание:
- Домены, мотивы и складки в структуре белка
- Определение [ править ]
- Третичная структура взаимодействия
- Ссылки [ править ]
- Уровни организации белков
- Вычислительное предсказание структуры белка
- Прогноз [ править ]
- Схема переваривания в желудочно-кишечном тракте
- Определение, состав и строение белка
- ДНК
- Уровни структуры белка
- Разница между первичной вторичной и третичной структурой белка
- Стабильность белка
- Строение и функции белков
Домены, мотивы и складки в структуре белка
Белковые домены. Две показанные белковые структуры имеют общий домен (темно-бордовый), домен PH , который участвует в связывании фосфатидилинозитол (3,4,5) -трисфосфата.
Белки часто описываются как состоящие из нескольких структурных единиц. Эти единицы включают домены, и складки. Несмотря на то, что существует около 100 000 различных белков, экспрессируемых в эукариотических системах, существует гораздо меньше различных доменов, структурных мотивов и складок.
Структурная область
Структурный домен является элементом общей структуры белка , что сам собой стабилизирующим и часто складки независимо от остальной части белковой цепи. Многие домены не являются уникальными для белковых продуктов одного гена или одного семейства генов, но вместо этого появляются во множестве белков. Домены часто называют и выделяют, потому что они играют важную роль в биологической функции белка, к которому они принадлежат; например, « кальций- связывающий домен кальмодулина ». Поскольку они независимы друг от друга, домены могут быть «обменены» с помощью генной инженерии между одним белком и другим, чтобы образовать химерные белки. Консервативная комбинация нескольких доменов, которые встречаются в разных белках, таких как домен протеинтирозинфосфатазы и пара доменов C2 , была названа «супердоменом», который может развиваться как единое целое.
Структурные и последовательные мотивы
В структурных и последовательность мотивов см коротких сегментов белка трехмерной структуры или аминокислотной последовательности , которые были обнаружены в большом количестве различных белков
Супервторичная структура
Supersecondary структура относится к конкретной комбинации вторичных структурных элементов, таких как β-α-бета единиц или спираль-поворот-спираль мотив. Некоторые из них можно также назвать структурными мотивами.
Белковая складка
Белковая складка относится к общей архитектуре белка, такой как пучок спиралей , β-бочка , складка Россмана или различные «складки», представленные в базе данных структурной классификации белков . Связанное с этим понятие — топология белка .
Определение [ править ]
Четвертичная структура белка может быть определена с использованием различных экспериментальных методик, для которых требуется образец белка в различных экспериментальных условиях. Эксперименты часто обеспечивают оценку массы нативного белка и вместе со знанием масс и / или стехиометрии субъединиц позволяют предсказать четвертичную структуру с заданной точностью. Точное определение субъединичного состава не всегда возможно по разным причинам.
Число субъединиц в белковом комплексе часто можно определить путем измерения гидродинамического молекулярного объема или массы интактного комплекса, что требует условий нативного раствора. Для свернутых белков массу можно вывести из их объема, используя частичный удельный объем 0,73 мл / г. Однако измерения объема менее надежны, чем измерения массы, поскольку развернутые белки, по-видимому, имеют гораздо больший объем, чем свернутые белки; необходимы дополнительные эксперименты, чтобы определить, развернулся ли белок или образовал олигомер.
Внутригенное дополнение править
Когда несколько копий полипептида, кодируемого геном, образуют четвертичный комплекс, эта структура белка называется мультимером. Когда мультимер формируется из полипептидов, продуцируемых двумя разными мутантными аллелями конкретного гена, смешанный мультимер может проявлять большую функциональную активность, чем несмешанные мультимеры, образованные каждым из мутантов по отдельности. В таком случае это явление называется внутригенной комплементацией (также называемой межаллельной комплементацией). Внутригенная комплементация, по-видимому, является обычным явлением и была изучена во многих различных генах у различных организмов, включая грибы Neurospora crassa , Saccharomyces cerevisiaeи Schizosaccharomyces pombe ; бактерия Salmonella typhimurium ; вирус бактериофага Т4 , вирус РНК, и человека. Межмолекулярные силы, вероятно ответственные за самопознание и образование мультимеров, обсуждались Джеле.
Третичная структура взаимодействия
Ниже приведены основные взаимодействия, которые составляют третичные структуры белков. Они управляют изгибом и скручиванием, которые помогают белковой молекуле достичь стабильного состояния. Мы можем наблюдать взаимодействия, которые являются ковалентными, где пары электронов распределяются между атомами, или нековалентными, когда пары электронов не распределяются между атомами. Напомним, что разрушение этих связей может привести к денатурации белка.
Гидрофобные взаимодействия
Эти нековалентные связи являются наиболее важным фактором и движущей силой в формировании третичной структуры.
Если мы разместим гидрофобный (ненавидящие воду) молекулы в воде, эти молекулы будут собираться вместе и образовывать большие куски гидрофобных молекул. Поскольку некоторые R-группы гидрофильный (любящий воду) и другие являются гидрофобными, все аминокислоты, содержащие гидрофильные боковые цепи, такие как изолейцин, будут обнаружены на поверхности белка, в то время как аминокислоты, которые имеют гидрофобные боковые цепи, такие как аланин, будут объединяться вместе в центре белка. Следовательно, белок, который образуется в воде, как и большинство из них, будет иметь гидрофобное ядро и гидрофильную поверхность
Это очень важно при определении того, как будет выглядеть третичная структура
Дисульфидные Мосты
Это очень сильные ковалентные связи, обнаруженные между остатками цистеина, которые находятся в непосредственной близости в космосе. Связи образуются между серными группами на различных остатках цистеина, как показано ниже.
Ионные облигации
Некоторые аминокислоты содержат боковые цепи, которые несут положительные или отрицательные заряды. Если аминокислота с положительным зарядом достаточно близка к аминокислоте, которая несет отрицательный заряд, они могут образовать связь, которая помогает стабилизировать молекулу белка.
Водородные связи
Мы можем наблюдать эти связи между молекулами воды в решение и гидрофильные аминокислотные боковые цепи на поверхности молекулы. Водородные связи также возникают между полярными боковыми цепями и помогают стабилизировать третичную структуру.
Ссылки [ править ]
- ^ Кларк, Джереми М. Берг; Джон Л. Тимочко; Люберт Страйер. Веб-контент Нил Д. (2002). «Раздел 3.5. Четвертичная структура: полипептидные цепи могут собираться в многосубъединичные структуры» . Биохимия (5. изд., 4. печатн. Изд.). Нью-Йорк, NY : WH Freeman. ISBN 0-7167-3051-0.
- ^ Чжоу, Куо-Чен; Цай, Ю-Дон (1 ноября 2003 г.). «Прогнозирование четвертичной структуры белка по псевдоаминокислотному составу». Белки: структура, функции и биоинформатика . 53 (2): 282–289. DOI10.1002 / prot.10500 . PMID 14517979 .
- ^ Крик, FH; Оргель, Л. Е. (1964). «Теория межаллельной комплементации». J Mol Biol . 8 : 161–5. DOI10.1016 / s0022-2836 (64) 80156-X . PMID 14149958 .
- ^ Бернштейн, H .; Эдгар, RS; Денхардт, Г. Х. (1965). «Внутригенная комплементация среди чувствительных к температуре мутантов бактериофага T4D» . Генетика . 51 (6): 987–1002. PMC 1210828 . PMID 14337770 .
- ^ Смоллвуд, S .; Cevik, B .; Мойер, С.А. (2002). «Внутригенная комплементация и олигомеризация субъединицы L РНК-полимеразы вируса Сендай». Вирусология . 304 (2): 235–245. DOI10.1006 / viro.2002.1720 .
- ^ Родригес-Помбо, P .; Pérez-Cerdá, C .; Pérez, B .; Desviat, LR; Sánchez-Pulido, L .; Угарте, М. (2005). «К модели для объяснения внутригенной комплементации в гетеромультимерном протеине пропионил-КоА-карбоксилазе» . Biochim Biophys Acta . 1740 (3): 489–498. DOI10.1016 / j.bbadis.2004.10.009 .
- ^ Йеле, H. (1963). «Межмолекулярные силы и биологическая специфичность» . Proc Natl Acad Sci USA . 50 (3): 516–524. DOI10.1073 / pnas.50.3.516 .
- ^ Chou KC, Cai YD (ноябрь 2003). «Прогнозирование четвертичной структуры белка по псевдоаминокислотному составу». Белки . 53 (2): 282–9. DOI10.1002 / prot.10500 . PMID 14517979 .
- ^ Чжан SW, W Chen, Ян F, Pan Q (октябрь 2008). «Использование псевдоаминокислотного состава Чоу для предсказания четвертичной структуры белка: подход PseAAC с сегментацией последовательностей». Аминокислоты . 35 (3): 591–8. DOI10.1007 / s00726-008-0086-х . PMID 18427713 .
- ^ Сяо, X .; Wang, P .; Чоу, KC (2009). «Предсказание четвертичного структурного атрибута белка путем гибридизации состава функциональных доменов и состава псевдоаминокислот». Журнал прикладной кристаллографии . 42 : 169–173. DOI10.1107 / S0021889809002751 .
- ^ Ardejani, Maziar S .; Чок, Сяо Линь; Фу, Се Джин; Орнер, Брендан П. (2 апреля 2013 г.). «Полный сдвиг олигомеризации ферритина в сторону сборки наноклеток через инженерные белок-белковые взаимодействия». Химические коммуникации . 49 (34): 3528–3530. DOI10.1039 / C3CC40886H . ISSN 1364-548X . PMID 23511498 .
- ^ a b Bertolini M, Fenzl K, Kats I, Wruck F, Tippmann F, Schmitt J, Auburger JJ, Tans S, Bukau B, Kramer G. Взаимодействия между возникающими белками, транслируемыми соседними рибосомами, управляют сборкой гомомеров. Наука. 2021, 1 января; 371 (6524): 57-64. DOI: 10.1126 / science.abc7151. PMID: 33384371
Уровни организации белков
Молекулы белков могут иметь различные пространственные конфигурации, и в их строении различают четыре уровня структурной организации.
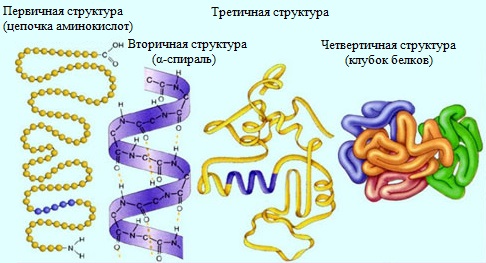
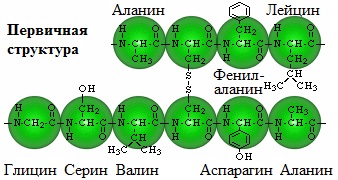
Первичная структура белка — определенная последовательность a-аминокислотных остатков в полипептидной цепи.
Пептидная цепь имеет линейную структуру только у небольшого числа белков. В большинстве белков пептидная цепь определенным образом свернута в пространстве.
Один из первых белков, первичная структура которого была установлена в 1954 г. — гормон инсулин (регулирует содержание сахара в крови), его молекула состоит из двух полипептидных цепей, которые связаны друг с другом (в одной цепи 21 аминокислотный остаток, в другой – 30).
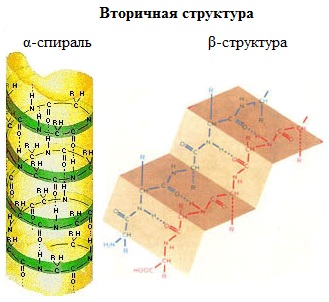
Вторичная структура белка — конформация полипептидной цепи, закрепленная множеством водородных связей между группами N-H и С=О.
В результате образования внутримолекулярных водородных связей между атомами водорода аминогрупп и атомами кислорода карбонильных групп полипептидные цепи многих белков скручиваются в спираль.
Существует два основных способа укладки цепи.
Одна из моделей вторичной структуры — a-спираль. Другая модель – β-форма («складчатый лист»), в которой преобладают межцепные (межмолекулярные) Н-связи.
В α-спирали на одном витке укладываются четыре аминокислотных остатка. Все радикалы аминокислот находятся снаружи спирали. Между группами NH и СО, находящимися на соседних витках, образуются водородные связи, которые стабилизируют спираль.
В β-структуре (складчатом слое) полипептидная цепь растянута, ее участки располагаются параллельно друг другу и удерживаются водородными связями.
Большинство белков содержит как α-спирали, так и β-структуры.
Вторичная структура была установлена американским химиком Л. Полингом в 1951 г.
Третичная структура белка — форма закрученной спирали в пространстве, образованная главным образом за счет дисульфидных мостиков -S-S- , водородных связей, гидрофобных и ионных взаимодействий.
Третичная структура – это трехмерная пространственная конфигурация закрученной α-спирали или β-структуры в пространстве.
У большинства белков полипептидные цепи свернуты особым образом в «клубок» — компактную «глобулу».
Белок в водном растворе свертывается таким образом, чтобы его гидрофобные (водоотталкивающие — от греч. гидро – вода, фобос – страх) боковые цепи были внутри молекулы, а гидрофильные (растворимые) – повернуты наружу.
Третичная структура образуется за счет дисульфидных мостиков -S-S- между цистеиновыми остатками, находящимися в разных местах полипептидной цепи.
В образовании третичной структуры участвуют также ионные взаимодействия противоположно заряженных групп (солевые мостики) NH3+ и COO— .
Интересно знать!
В составе волос содержится белок кератин. В его молекуле имеется большое количество дисульфидных связей. С помощью химической завивки волосам можно придать другую форму. Для этого волосы сначала накручивают на бигуди, затем обрабатывают раствором реагента-восстановителя, разрушающего дисульфидные связи, и прогревают. В результате этого кератин приобретает иную пространственную структуру. Далее волосы промывают и обрабатывают реагентом-окислителем, при этом происходит образование новых дисульфидных связей. Вследствие этого вновь приобретенная структура кератина стабилизируется. Волосы приобретают другую форму.
Четвертичная структура белка — агрегаты нескольких белковых макромолекул (белковые комплексы), образованные за счет взаимодействия разных полипептидных цепей.
Четвертичная структура – способ совместной укладки нескольких полипептидных цепей. Образующиеся структуры называются ассоциатами.
Термин «четвертичная структура» был предложен в 1958 г. Дж. Берналом.
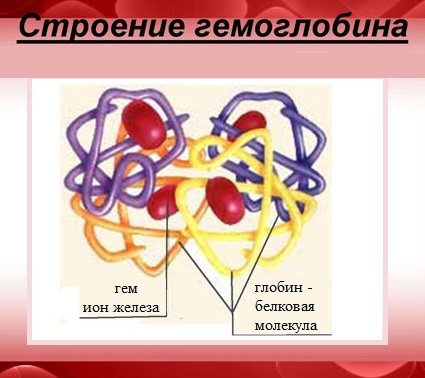
Характерной особенностью белков с четвертичной структурой является их способность к самосборке, например, гемоглобин (белок крови) легко собирается из смеси α- и β-цепей и гема.
Гемоглобин — сложный белок, макромолекула которого состоит из четырех полипептидных цепей (глобул), соединенных с четырьмя гемами – небелковыми образованиями, которые и придают крови красный цвет.
В каждом геме содержится один атом двухвалентного железа, который может непрочно связывать одну молекулу кислорода. В результате такого связывания образуется оксигемоглобин, одна молекула которого переносит к тканям четыре молекулы кислорода.
Из тканей гемоглобин выносит углекислый газ, молекулы которого присоединяются к аминогруппам, содержащимся в полипептидных цепях.
Рубрики: Белки
Вычислительное предсказание структуры белка
Создание белковой последовательности намного проще, чем определение структуры белка. Однако структура белка дает гораздо больше информации о функции белка, чем его последовательность. Поэтому был разработан ряд методов компьютерного предсказания структуры белка по его последовательности. В методах предсказания ab initio используется только последовательность белка. Методы моделирования потоков и гомологии позволяют построить трехмерную модель для белка неизвестной структуры из экспериментальных структур эволюционно связанных белков, называемых семейством белков .
Прогноз [ править ]
Прогнозирование третичной структуры белка только по его аминокислотной последовательности — очень сложная задача (см. Прогнозирование структуры белка ), но использование более простых определений вторичной структуры более легко поддается решению.
Ранние методы прогнозирования вторичной структуры ограничивались прогнозированием трех преобладающих состояний: спирали, листа или случайной спирали. Эти методы были основаны на склонности отдельных аминокислот к образованию спиралей или листов, иногда в сочетании с правилами оценки свободной энергии образующихся элементов вторичной структуры. Первыми широко используемыми методами предсказания вторичной структуры белка по аминокислотной последовательности были метод Чоу – Фасмана и метод GOR . Хотя такие методы утверждали, что они достигают ~ 60% точности в предсказании того, какое из трех состояний (спираль / лист / рулон) принимает остаток, слепые вычисления позже показали, что фактическая точность была намного ниже.
Значительное увеличение точности (почти до ~ 80%) было достигнуто за счет использования множественного выравнивания последовательностей ; Знание полного распределения аминокислот, которые встречаются в позиции (и в ее окрестностях, обычно ~ 7 остатков с каждой стороны) на протяжении эволюции, дает гораздо лучшую картину структурных тенденций в этой позиции. Для иллюстрации, данный белок может иметь глицин в данном положении, что само по себе может указывать на случайный клубок. Однако множественное выравнивание последовательностей может выявить, что благоприятные для спирали аминокислоты встречаются в этом положении (и близлежащих положениях) в 95% гомологичных белков, охватывающих почти миллиард лет эволюции. Более того, исследуя среднийгидрофобность в этом и близлежащих положениях, то же самое выравнивание может также указывать на образец доступности остатка для растворителя, совместимый с α-спиралью. Взятые вместе, эти факторы предполагают, что глицин исходного белка имеет α-спиральную структуру, а не случайную спираль. Несколько типов методов используются для объединения всех доступных данных для формирования предсказания с тремя состояниями, включая нейронные сети , скрытые марковские модели и вспомогательные векторные машины . Современные методы прогнозирования также обеспечивают оценку достоверности своих прогнозов на каждой позиции.
Методы прогнозирования вторичной структуры оценивались экспериментами по критической оценке прогнозирования структуры белка (CASP) и постоянно тестировались, например, с помощью EVA (эталонный тест) . Основываясь на этих тестах, наиболее точными методами были Psipred , SAM, PORTER, PROF, и SABLE. Главной областью для улучшения, по-видимому, является предсказание β-нитей; остатки, уверенно предсказанные как β-цепь, скорее всего, будут таковыми, но методы склонны упускать из виду некоторые сегменты β-цепи (ложноотрицательные результаты). Вероятно, существует верхний предел точности прогноза ~ 90% в целом из-за особенностей стандартного метода ( DSSP) для присвоения классов вторичной структуры (спираль / нить / спираль) структурам PDB, с которыми сравниваются прогнозы.
Точное предсказание вторичной структуры является ключевым элементом в предсказании третичной структуры во всех случаях, кроме простейших ( моделирование гомологии ). Например, уверенно предсказанный паттерн из шести элементов вторичной структуры βαββαβ является признаком ферредоксиновой складки.
Схема переваривания в желудочно-кишечном тракте
В ходе переваривания происходит гидролиз пищевых белков до свободных аминокислот. Расщепление до аминокислот начинается в желудке, затем продолжается в двенадцатиперстной кишке. Финальная стадия происходит в тонком кишечнике. В некоторых случаях процесс распада и переформирования в аминокислоты может проходить и в толстом кишечнике под влиянием микрофлоры. В тонком кишечнике процесс переваривания проходит под влиянием ферментов пептидгидролаз.
Сложные белки
Внимание! Согласно изучениям биохимиков, альтернативным названием пептидгидролаз является пептидаз. И основные пептидазы синтезируются в клетках самого желудка, поджелудочной железы и кишечника
В желудке белки, которые были получены с продуктами, денатурируются и гидролизуются, впоследствии образуя олигопептиды. В кишечнике панкреатические пептидгидролазы продолжают процесс гидролиза полученных олигопептидов, образуются дипептиды и трипептиды, свободные кислоты. Короткие пептиды распадаются до свободных аминокислот в клетках кишечного эпителия и в пристеночном слое, после чего происходит процесс всасывания.
Определение, состав и строение белка
Белки являются биополимерами, мономерами которых являются остатки альфа-аминокислот, соединенные между собой посредством пептидных связей. Аминокислотная последовательность каждого белка строго определена, в живых организмах она зашифрована посредством генетического кода, на основе считывания которого и происходит биосинтез белковых молекул. В построении белков участвует 20 аминокислот.

Рис. 1. Схема образования молекулы белка (дипептида).
Различают следующие виды структуры белковых молекул:
- Первичная. Представляет собой аминокислотную последовательность в линейной цепи.
- Вторичная. Это более компактная укладка полипептидных цепей при помощи формирования водородных связей между пептидными группами. Есть два варианта вторичной структуры – альфа-спираль и бета-складчатость.
- Третичная. Представляет собой укладку полипептидной цепочки в глобулу. При этом формируются водородные, дисульфидные связи, также стабилизация молекулы реализуется благодаря гидрофобным и ионным взаимодействиям аминокислотных остатков.
- Четвертичная. Белок состоит из нескольких полипептидных цепей, которые взаимодействуют между собой посредством нековалентных связей.
Таким образом, соединенные в определенной последовательности аминокислоты образуют полипептидную цепь, отдельные части которой сворачиваются в спираль или формируют складки. Такие элементы вторичной структур образуют глобулы, формируя третичную структуру белка. Отдельные глобулы взаимодействуют между собой, образуя сложные белковые комплексы с четвертичной структурой.

Рис. 2. Структурная организация белков.
ДНК
Четвертичная структура ДНК используется для обозначения связывания ДНК с гистонами с образованием нуклеосом , а затем их организации в волокна хроматина более высокого порядка . Четвертичная структура ДНК сильно влияет на доступность последовательности ДНК для транскрипционного аппарата для экспрессии генов. Четвертичная структура ДНК меняется со временем, поскольку участки ДНК конденсируются или подвергаются транскрипции. Этот термин также использовался для описания иерархической сборки искусственных строительных блоков нуклеиновых кислот, используемых в нанотехнологии ДНК .
Четвертичная структура ДНК относится к образованию хроматина. Поскольку геном человека очень велик, ДНК должна быть конденсирована в хроматин, который состоит из повторяющихся единиц, известных как нуклеосомы . Нуклеосомы содержат ДНК и белки, называемые гистонами . Ядро нуклеосомы обычно содержит около 146 пар оснований ДНК, обернутых вокруг октамера гистонов . Гистоновый октамер состоит из восьми общих гистоновых белков, по два из следующих белков: H2A, H2B, H3 и H4. Гистоны в первую очередь отвечают за формирование нуклеосом, поэтому вносят существенный вклад в структуру хроматина. Гистоновые белки заряжены положительно и поэтому могут взаимодействовать с отрицательно заряженным фосфатным остовом ДНК. Одна часть ядер гистоновых белков, известная как гистоновые хвостовые домены, чрезвычайно важна для сохранения плотно обернутой нуклеосомы и придания нуклеосоме вторичной и третичной структуры. Это связано с тем, что домены гистонового хвоста участвуют во взаимодействиях между нуклеосомами. Линкерный гистон или белок H1 также участвует в поддержании структуры нуклеосомы. Белок H1 играет особую роль в том, чтобы ДНК оставалась плотно скрученной.
Модификации гистоновых белков и их ДНК классифицируются как четвертичные структуры. Конденсированный хроматин, гетерохроматин , препятствует транскрипции генов. Другими словами, факторы транскрипции не могут получить доступ к раневой ДНК — в отличие от эухроматина , который деконденсируется и, следовательно, легко доступен для транскрипционного аппарата. Метилирование ДНК до нуклеотидов влияет на четвертичную структуру хроматина. Сильно метилированные нуклеотиды ДНК чаще встречаются в гетерохроматине, тогда как неметилированные нуклеотиды ДНК распространены в эухроматине. Более того, посттрансляционные модификации могут быть внесены в основные гистоновые хвостовые домены, которые приводят к изменениям в четвертичной структуре ДНК и, следовательно, к экспрессии генов. Ферменты , известные как эпигенетические писатели и эпигенетические стиратели, катализируют добавление или удаление нескольких модификаций хвостовых доменов гистонов. Например, пишущий фермент может метилировать лизин-9 основного белка H3, который находится в хвостовом домене гистона H3. Это может привести к репрессии генов, поскольку хроматин перестраивается и становится похожим на гетерохроматин. Однако десятки модификаций могут быть сделаны в доменах гистоновых хвостов. Следовательно, именно сумма всех этих модификаций определяет, будет ли хроматин напоминать гетерохроматин или эухроматин.
Трехмерный складной мотив, известный как петля для поцелуев. На этой диаграмме наложены две модели цикла поцелуев, чтобы показать структурное сходство. Белая основа и розовая основа взяты из B. subtilis , а серая основа и голубая основа — от V. vulnificus .
Взаимодействие с второстепенным мотивом
Уровни структуры белка
Есть четыре различных уровня структуры белка.

Четыре уровня белковой структуры
Первичная структура
Первичная структура белка относится к последовательности аминокислот в полипептидной цепи. Первичная структура удерживается вместе пептидными связями, которые образуются в процессе биосинтеза белка . Два конца полипептидной цепи называются карбоксильным концом (С-конец) и аминным концом (N-концом) в зависимости от природы свободной группы на каждом конце. Подсчет остатков всегда начинается с N-конца (NH 2 -группа), который является концом, на котором аминогруппа не участвует в пептидной связи. Первичная структура белка определяется геном, соответствующим белку. Конкретная последовательность нуклеотидов в ДНК является транскрибируется в мРНК , которая считывается рибосомой в процессе , называемом переводом . Последовательность аминокислот в инсулине была открыта Фредериком Сэнгером , установив, что белки имеют определяющие аминокислотные последовательности. Последовательность белка уникальна для этого белка и определяет структуру и функцию белка. Последовательность белка можно определить такими методами, как деградация по Эдману или . Однако часто он считывается непосредственно из последовательности гена с использованием генетического кода . При обсуждении белков строго рекомендуется использовать слова «аминокислотные остатки», потому что при образовании пептидной связи молекула воды теряется, и, следовательно, белки состоят из аминокислотных остатков. Посттрансляционные модификации, такие как фосфорилирование и гликозилирование , обычно также считаются частью первичной структуры и не могут быть прочитаны из гена. Например, инсулин состоит из 51 аминокислоты в 2 цепях. Одна цепь состоит из 31 аминокислоты, а другая — из 20 аминокислот.
Вторичная структура
Α-спираль с водородными связями (желтые точки)
Вторичная структура относится к очень регулярным локальным субструктурам на фактической основной цепи полипептида. Два основных типа вторичной структуры, α-спираль и β-цепь или β-листы , были предложены в 1951 году Linus Pauling et al. Эти вторичные структуры определяются типом водородных связей между пептидными группами основной цепи. Они имеют правильную геометрию и ограничиваются конкретными значениями двугранных углов ψ и φ на графике Рамачандрана . Как α-спираль, так и β-лист представляют собой способ насыщения всех доноров и акцепторов водородных связей в основной цепи пептида. Некоторые части белка упорядочены, но не образуют регулярных структур. Их не следует путать со случайной спиралью , развернутой полипептидной цепью, лишенной какой-либо фиксированной трехмерной структуры. Несколько последовательных вторичных структур могут образовывать « супервторичный блок ».
Третичная структура
Третичная структура относится к трехмерной структуре, созданной одной молекулой белка (одной полипептидной цепью ). Он может включать в себя один или несколько доменов . Α-спирали и β-складки складываются в компактную глобулярную структуру . Сворачивание происходит за счет неспецифических гидрофобных взаимодействий , захоронения гидрофобных остатков из воды , но структура остается стабильной только тогда, когда части белкового домена фиксируются на месте посредством специфических третичных взаимодействий, таких как солевые мостики , водородные связи и т. Д. и плотная упаковка боковых цепей и дисульфидных связей . Дисульфидные связи чрезвычайно редки в цитозольных белках, поскольку цитозоль (внутриклеточная жидкость) обычно является восстанавливающей средой.
Четвертичная структура
Четвертичная структура — это трехмерная структура, состоящая из агрегации двух или более отдельных полипептидных цепей (субъединиц), которые действуют как единая функциональная единица ( мультимер ). Полученный мультимер стабилизируется теми же нековалентными взаимодействиями и дисульфидными связями, что и в третичной структуре. Есть много возможных организаций с четвертичной структурой. Комплексы из двух или более полипептидов (т.е. множества субъединиц) называются мультимерами . В частности, он будет называться димером, если он содержит две субъединицы, тример, если он содержит три субъединицы, тетрамер, если он содержит четыре субъединицы, и пентамер, если он содержит пять субъединиц. Субъединицы часто связаны друг с другом операциями симметрии , такими как 2-кратная ось в димере. Мультимеры, состоящие из идентичных субъединиц, обозначаются с префиксом «гомо-», а мультимеры, состоящие из разных субъединиц, обозначаются с префиксом «гетеро-», например, гетеротетрамер, такой как два альфа и два бета. цепочки гемоглобина .
Разница между первичной вторичной и третичной структурой белка
Определение
Первичная структура белка представляет собой линейную последовательность аминокислот, вторичная структура белка представляет собой складывание пептидной цепи в α-спираль или β-лист, в то время как третичная структура представляет собой трехмерную структуру белка. Это объясняет принципиальную разницу между первичной вторичной и третичной структурой белка.
форма
Как сказано в определении, первичная структура белка является линейной, вторичная структура белка может представлять собой α-спираль или β-лист, а третичная структура белка является глобулярной.
облигации
Первичная структура белка состоит из пептидных связей, образованных между аминокислотами, вторичная структура белка включает в себя водородные связи, тогда как третичная структура белка включает дисульфидные мостики, солевые мостики и водородные связи. В этом основное отличие первичной вторичной и третичной структуры белка.
Примеры
Первичная структура белка формируется во время трансляции. Вторичная структура белков образует коллаген, эластин, актин, миозин и кератиноподобные волокна, в то время как третичная структура белков включает ферменты, гормоны, альбумин, глобулин и гемоглобин.
Функции в ячейке
Их функции являются еще одним важным отличием первичной вторичной и третичной структуры белка. Первичная структура белка участвует в посттрансляционных модификациях, вторичная структура белков участвует в формировании таких структур, как хрящи, связки, кожа и т. Д., А третичная структура белков участвует в метаболических функциях организма.
Заключение
Первичная структура белка представляет собой аминокислотную последовательность, которая является линейной. Это производится во время перевода. Вторичная структура белка представляет собой либо α-спираль, либо β-слой, образованный в результате образования водородных связей. Он играет важную роль в формировании структур, таких как волокна коллагена, эластина, актина, миозина и кератина. Третичная структура белка является глобулярной и образуется в результате образования дисульфидных и солевых мостиков. Он играет жизненно важную роль в обмене веществ. Разница между первичной вторичной и третичной структурой белка заключается в их структуре, связях и роли в клетке.
Стабильность белка
Термодинамическая стабильность белков представляет собой разницу свободной энергии между свернутым и развернутым состояниями белка. Эта разница в свободной энергии очень чувствительна к температуре, поэтому изменение температуры может привести к разворачиванию или денатурации. Денатурация белка может привести к потере функции и потере нативного состояния. Свободная энергия стабилизации растворимых глобулярных белков обычно не превышает 50 кДж / моль
Принимая во внимание большое количество водородных связей, которые имеют место для стабилизации вторичных структур, и стабилизации внутреннего ядра посредством гидрофобных взаимодействий, свободная энергия стабилизации проявляется как небольшая разница между большими числами.
Строение и функции белков
Белки (протеины) составляют 50% от сухой массы живых организмов.
Белки состоят из аминокислот. У каждой аминокислоты есть аминогруппа и кислотная (карбоксильная) группа, при взаимодействии которых получается пептидная связь, поэтому белки еще называют полипептидами.
Структуры белка
Первичная – цепочка из аминокислот, связанных пептидной связью (сильной, ковалентной). Чередуя 20 аминокислот в разном порядке, можно получать миллионы разных белков.
Если поменять в цепочке хотя бы одну аминокислоту, строение и функции белка изменятся, поэтому первичная структура считается самой главной в белке.
Вторичная – спираль. Удерживается водородными связями (слабыми).
Третичная – глобула (шарик). Четыре типа связей: дисульфидная (серный мостик) сильная, остальные три (ионные, гидрофобные, водородные) – слабые.
Форма глобулы у каждого белка своя, от нее зависят функции. При денатурации форма глобулы меняется, и это сказывается на работе белка.
Четвертичная – имеется не у всех белков. Состоит из нескольких глобул, соединенных между собой теми же связями, что и в третичной структуре. (Например, гемоглобин.)
Денатурация
Это изменение формы глобулы белка, вызванное внешними воздействиями (температура, кислотность, соленость, присоединение других веществ и т.п.)
- Если воздействия на белок слабые (изменение температуры на 1°), то происходит обратимая денатурация.
- Если воздействие сильное (100°), то денатурация необратимая.
При этом разрушаются все структуры, кроме первичной.
Функции белков
Их очень много, например:
Ферментативная (каталитическая) – белки-ферменты ускоряют химические реакции за счет того, что активный центр фермента подходит к веществу по форме, как ключ к замку (комплементарность, специфичность).
- Строительная (структурная) – клетка, если не считать воду, состоит в основном из белков.
- Защитная – антитела борются с возбудителями болезней (иммунитет).






