Разница между первичной вторичной и третичной структурой белка
Содержание:
- Введение
- Физические и химические свойства
- Определение, состав и строение белка
- Денатурация белка
- Взаимодействия, ответственные за конформационную стабильность белков
- Белки как биополимеры. Свойства и биологические функции белков
- Типы третичных структур
- Уровни организации белков
- структура белка
- Вторичная структура ДНК
- Примечания
- Вторичная структура РНК
- Бета-слой вторичной структуры
Введение
Для функционирования белков крайне важна как их аминокислотного (пептидная) последовательность, так и трехмерная структура, которая формируется в процессе свертывания (англ. Folding).
Трехмерная структура белков с нормальными природными условиями называется нативным состоянию белка. Обычно структура белков делится на четыре уровня:
- Первичная структура — последовательность аминокислот в пептидной цепи.
- Вторичная структура — регулярные под-структуры (например альфа-спирали и бета-листы), которые определяются локально, таким образом что в одной молекуле белка обычно существует много подобных структурных элементов (мотивов).
- Третичная структура — трехмерная структура единой белковой молекулы, пространственное расположение вторичных структур.
- Четвертичная структура — комплекс из нескольких молекул белка или полипептидных цепочек, который обычно называют белком в этом контексте, функционирующих вместе в составе белкового комплекса.
В дополнение к этим уровням структуры, белок может изменяться между несколькими подобными структурами в процессе осуществления своей биологической функции. В контексте этих функциональных перестановок, эти третичные или четвертные структуры обычно называются конформациями, а переходы между ними — конформационными изменениями.
Первичная структура удерживается с помощью пептидных связей типа ковалентных связей, образующихся в процессе стадии трансляции биосинтеза белков. Эти пептидные связи обеспечивают жесткость белка. Два конца аминокислотного цепочки называются C-концом или карбоксильным концом и N-конец или амино концов, заснувуючись природе свободной группы на каждом конце.
Различные виды вторичной структуры возникают локально между аминокислотами полипептидной цепочки и стабилизируются водородными связями. Однако, эти водородные связи в целом недостаточно устойчивы самостоятельно, потому что водородная связь с молекулами воды обычно благоприятный, чем водородная связь между амидными группами. Поэтому вторичная структура устойчива только когда локальная концентрация воды достаточно низкая, например, в пределах глобулы или в полностью свернутом белка.
Так же как и вторичная структура, образование глобул и третичной структуры стабилизируется преимущественно структурно неспецифическими взаимодействиями, например сродством аминокислот и гидрофобными взаимодействиями. Однако, третичная структура стабилизируется только когда некоторые части белка закреплены структурно специфическими взаимодействиями, например ионными связями (солевыми мостиками), водородными связями и стеричною упаковкой боковых цепочек. Третичная структура внеклеточных белков может также стабилизироваться дисульфидными связями, которые сокращают энтропию развернутого состояния. Дисульфидные связи чрезвычайно редки в цитоплазмених белках, потому что цитозоль обычно восстанавливающим окружением.
Физические и химические свойства
Физические свойства:
- агрегатное состояние (твердые, жидкие и полужидкие, студнеобразные);
- цвет (обычно белки бесцветны, но, если в состав входят ионы металлов, могут приобретать яркую окраску — например, гемоглобин);
- растворимость в воде и солевых растворах (твердые, как правило, нерастворимы, а жидкие и студнеобразные — растворимы);
- подвижность в электрическом поле;
- молекулярная массы;
- существование в форме нитей, гранул, шариков.
Химические свойства:
- амфотерность (наличие функциональных групп кислотной и основной природы);
- гидролиз, результатом которого является образование аминокислот;
- горение с выделением углекислого газа, азота, воды;
- денатурация — разрушение преимущественно третичной структуры под воздействием температуры, химических реагентов, излучения и т.д.
Белки способны набухать, поглощая воду. Явление прочного связывания воды белками называется гидратацией.
Определение, состав и строение белка
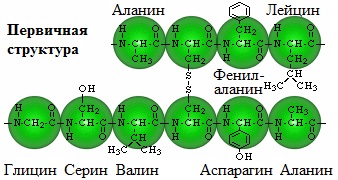
Белки являются биополимерами, мономерами которых являются остатки альфа-аминокислот, соединенные между собой посредством пептидных связей. Аминокислотная последовательность каждого белка строго определена, в живых организмах она зашифрована посредством генетического кода, на основе считывания которого и происходит биосинтез белковых молекул. В построении белков участвует 20 аминокислот.

Рис. 1. Схема образования молекулы белка (дипептида).
Различают следующие виды структуры белковых молекул:
- Первичная. Представляет собой аминокислотную последовательность в линейной цепи.
- Вторичная. Это более компактная укладка полипептидных цепей при помощи формирования водородных связей между пептидными группами. Есть два варианта вторичной структуры – альфа-спираль и бета-складчатость.
- Третичная. Представляет собой укладку полипептидной цепочки в глобулу. При этом формируются водородные, дисульфидные связи, также стабилизация молекулы реализуется благодаря гидрофобным и ионным взаимодействиям аминокислотных остатков.
- Четвертичная. Белок состоит из нескольких полипептидных цепей, которые взаимодействуют между собой посредством нековалентных связей.
Таким образом, соединенные в определенной последовательности аминокислоты образуют полипептидную цепь, отдельные части которой сворачиваются в спираль или формируют складки. Такие элементы вторичной структур образуют глобулы, формируя третичную структуру белка. Отдельные глобулы взаимодействуют между собой, образуя сложные белковые комплексы с четвертичной структурой.

Рис. 2. Структурная организация белков.
Денатурация белка
Так долго мы добирались до четвертичной структуры, но теперь время все УНИЧТОЖИТЬ. Денатурация — это потеря функции белка, через разрушение его четвертичной, третичной и вторичной структуры. Но не первичной! Процесс может остановиться и раньше, не дойдя до первичной
Но самое важное — белок перестает работать. Это значит вот что: если у белка есть только третичная структура, то её потеря приведёт к потере функций
Тоже самое касается белков с четвертичной структурой.
Денатурирующие факторы делятся на физические и химические.
Физические факторы
У всех этих факторов общий механизм действия. Они вносят в систему дополнительное количество энергии. Это вызывает увеличение амплитуды колебательных движений фрагментов полипептидной цепи. Из-за этого рвутся слабые связи, стабилизирующие белковую молекулу — водородные, гидрофобные и Ван-дер-Вальсовы. Вот некоторые из этих факторов:
- Повышение температуры больше 42 градусов;
- Повышение давления;
- Ультрафиолетовое излучение;
- Рентгеновское излучение;
- Инфракрасное излучение (коротковолновое);
- Сверхчастотное излучение;
- Вибрация.
Химические факторы
Химические денатурирующие факторы различаются по механизму действия. Так что разбираемся с каждым отдельно. Представим, что мы рвём каждую связь:
1) Добавим кислоту или щелочь в раствор, где находится белок — произойдет изменение заряда некоторых аминокислот. Раз изменился заряд, то происходит разрушение водородных и ионных связей.
2) Детергенты — это вещества, у которых есть гидрофобные и гидрофильные участки. Если засунуть их внутрь молекулы, то гидрофобное взаимодействие нарушится. Примеры детергентов — фенолы, додецилсульфат.
3) С помощью тяжелых металлов мы порвем дисульфидные мостики в третичной структуре. Такими тяжелыми металлами будут: свинец, медь и ртуть.
4) Восстанавливающие агенты — восстанавливают дисульфидные связи. Смысл такой же, как и с тяжелыми металлами: разрушение дисульфидных мостиков. Пример — меркаптоэтанол.
5) Вещества, образующие водородные связи — мочевина. Это ужасная воровка, она перетягивает водородные связи с белка на себя.
Виды денатурирующих агентов. Все физические агенты не поместились.
Но, мы сказали, что это разрушает вторичную, третичную и четвертичную структуры, но не первичную. Она остается целой. А так как она отвечает за формирование всех остальных, то при удалении денатурирующего фактора белок может снова стать работоспособным, восстановив свою структуру. Это процесс называется ренативация белка. Для этого нужны определённые условия, но они не всегда достижимы в клетке. Поэтому для большинства белков денатурация — это необратимый процесс.
Хочешь задать вопрос, похвалить или наговорить гадостей? Тогда залетай в телегу. Там ты сможешь предложить новый формат или разбор темы. А если серьёзно, то эти статьи пишутся для вас, поэтому мне важна обратная связь.
Структура БелкаСкачать
Взаимодействия, ответственные за конформационную стабильность белков
Принято считать, что структура «нативного» белка является термодинамически наиболее стабильной структурой. За исключением дисульфидных мостиков, которые существуют только в определенных белках, в основном внеклеточных белках, взаимодействия, которые стабилизируют конформацию этих молекул, являются нековалентными взаимодействиями. Все такие взаимодействия, которые происходят в небольших молекулах, также существуют в белках. С другой стороны, нековалентные взаимодействия имеют место между различными группами белка, а также между этими группами и молекулами растворителя.
Таким образом, конформационная энергия белковой молекулы складывается из нескольких вкладов. Некоторые из этих вкладов являются результатом факторов, присущих белку: это взаимодействия Ван-дер-Ваальса (несвязанные взаимодействия), которые включают член притяжения и член отталкивания, торсионные потенциалы, энергии напряжения в углах или длинах связей. Другие возникают в результате внутримолекулярных взаимодействий под влиянием растворителя, таких как водородные связи и электростатические взаимодействия. Третьи в основном определяются растворителем, это гидрофобные взаимодействия. В водородных связях и гидрофобные взаимодействия имеют противоположный знак зависимость от температуры. Эти водородные связи являются более стабильными при низких температурах, в отличие от гидрофобных взаимодействий; следовательно, температура, соответствующая максимальной стабильности, зависит от пропорции этих взаимодействий и, следовательно, варьируется от одного белка к другому. Нативная структура белка является результатом тонкого баланса между различными стабилизирующими взаимодействиями и конформационной энтропией, которая имеет тенденцию дестабилизировать целое.
Белки как биополимеры. Свойства и биологические функции белков
Белки – это биополимеры, состоящие из остатков α-аминокислот, соединённых между собой пептидными связями (-CO-NH-). Белки входят в состав клеток и тканей всех живых организмов. В молекулы белков входит 20 остатков различных аминокислот.
Структура белка
Белки обладают неисчерпаемым разнообразием структур.
Первичная структура белка – это последовательность аминокислотных звеньев в линейной полипептидной цепи.
Вторичная структура – это пространственная конфигурация белковой молекулы, напоминающая спираль, которая образуется в результате скручивания полипептидной цепи за счёт водородных связей между группами: CO и NH.
Третичная структура – это пространственная конфигурация, которую принимает закрученная в спираль полипептидная цепь.
Четвертичная структура – это полимерные образования из нескольких макромолекул белка.
Физические свойства
Свойства белков весьма разнообразны, которые они выполняют.
Одни белки растворяются в воде, образуя, как правило, коллоидные растворы (например, белок яйца); другие растворяются в разбавленных растворах солей; третьи нерастворимы (например, белки покровных тканей).
Химические свойства
1. Денатурация – разрушение вторичной, третичной структуры белка под действием различных факторов: температура, действие кислот, солей тяжёлых металлов, спиртов и т.д.
2. Качественные реакции на белки:
а) При горении белка – запах палёных перьев.
б) Белок +HNO3 → жёлтая окраска
в) Раствор белка +NaOH + CuSO4 → фиолетовая окраска
3. Гидролиз
Белок + Н2О → смесь аминокислот
Функции белков в природе:
- каталитические (ферменты);
- регуляторные (гормоны);
- структурные (кератин шерсти, фиброин шелка, коллаген);
- двигательные (актин, миозин);
- транспортные (гемоглобин);
- запасные (казеин, яичный альбумин);
- защитные (иммуноглобулины) и т.д.
25. Общая характеристика высокомолекулярных соединений: состав, строение, реакции, лежащие в основе их получения (на примере полиэтилена или синтетического каучука).
Высокомолекулярными соединениями (ВМС) или полимерами называются вещества, имеющие большую молекулярную массу, состоящую из множества повторяющихся структурных звеньев.
Существуют природные полимеры (крахмал, белки, целлюлоза, каучук) и синтетические полимеры (полиэтилен, фенопласты). Низкомолекулярные вещества, из которых синтезируют полимеры, называются мономерами.
CH2=CH2 мономер полиэтилена — этилен
(-CH2-CH2-)n –молекула полимера
-CH2-CH2- – структурное звено – многократно повторяющаяся группа атомов
n – степень полимеризации (число звеньев в молекуле полимера)
Молекулярная масса полимера непостоянна и зависит от числа n.
Макромолекулы полимеров могут иметь различную пространственную структуру:
1. Линейную (полиэтилен, полипропилен);
2. Разветвлённую (крахмал);
3. Пространственную (резина).
Физические свойства
Полимеры имеют высокую механическую прочность. Химически стойкие (с кислотами и щелочами не реагируют). Не имеют определённой температуры плавления, не растворяются в воде и в большинстве органических растворителей.
Синтез полимеров
Полимеры синтезируют двумя способами:
Реакцией полимеризации;
2. Реакцией поликонденсации.
Реакцией полимеризации называется процесс соединения молекул мономера в более крупные молекулы.
n CH2=CH2 → (-CH2-CH2-)n
этилен полиэтилен
Полиэтилен – полупрозрачный материал, жирный на ощупь, воздухо- и влагонепроницаем, легкоплавкий, химически стойкий, не гниёт, диэлектрик. Применяется для производства плёнок, труб, бытовых изделий (посуда, игрушки), электроизоляции, поверхностных покрытий.
Реакцией поликонденсации называется процесс получения высокомолекулярных веществ, идущих с выделением побочного низкомолекулярного продукта.
Типы третичных структур
Глобулярные белки
Большинство белков попадают в эту категорию. Глобулярные белки образуют компактную шариковидную форму, где гидрофобные аминокислоты находятся в центре структуры, а гидрофильные аминокислоты находятся на поверхности, образуя молекулу, которая растворима в воде. Многие глобулярные белки имеют домены, которые являются локально свернутыми частями третичной структуры, в пределах от 50 аминокислот до 350 аминокислот. Один домен может быть найдено более чем в одном белке, если белки имеют сходные функции, а белок с множественными функциями может иметь более одного домена, каждый из которых играет определенную роль. Примером глобулярных белков являются ферменты, найденные в наших клетках.
Волокнистые белки
Волокнистые белки состоят из волокон, часто состоящих из повторяющихся последовательностей аминокислот, в результате чего получается высокоупорядоченная удлиненная молекула. Они включают хрящ, который обеспечивает структурную поддержку и нерастворим в воде.
- кофактор – Важный небелковый компонент в ферментах, который активирует их или играет роль в химических реакциях.
- изомер – Соединения с различным расположением атомов, но одинаковыми химическая формула,
- лиганд – вещество, такое как гормон, который связывается с определенной биомолекулой, чтобы служить цели.
- Четвертичная структура – Формируется, когда несколько белковых субъединиц объединяются в комплекс.
Уровни организации белков
Молекулы белков могут иметь различные пространственные конфигурации, и в их строении различают четыре уровня структурной организации.
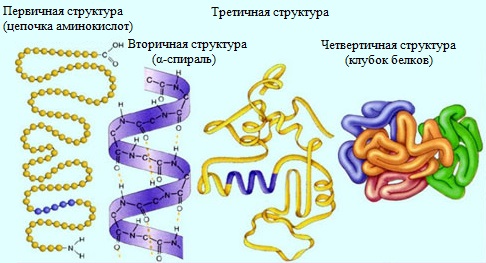
Первичная структура белка — определенная последовательность a-аминокислотных остатков в полипептидной цепи.
Пептидная цепь имеет линейную структуру только у небольшого числа белков. В большинстве белков пептидная цепь определенным образом свернута в пространстве.
Один из первых белков, первичная структура которого была установлена в 1954 г. — гормон инсулин (регулирует содержание сахара в крови), его молекула состоит из двух полипептидных цепей, которые связаны друг с другом (в одной цепи 21 аминокислотный остаток, в другой – 30).
Вторичная структура белка — конформация полипептидной цепи, закрепленная множеством водородных связей между группами N-H и С=О.
В результате образования внутримолекулярных водородных связей между атомами водорода аминогрупп и атомами кислорода карбонильных групп полипептидные цепи многих белков скручиваются в спираль.
Существует два основных способа укладки цепи.
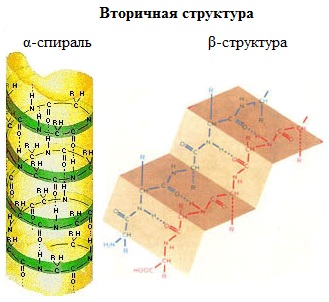
Одна из моделей вторичной структуры — a-спираль. Другая модель – β-форма («складчатый лист»), в которой преобладают межцепные (межмолекулярные) Н-связи.
В α-спирали на одном витке укладываются четыре аминокислотных остатка. Все радикалы аминокислот находятся снаружи спирали. Между группами NH и СО, находящимися на соседних витках, образуются водородные связи, которые стабилизируют спираль.
В β-структуре (складчатом слое) полипептидная цепь растянута, ее участки располагаются параллельно друг другу и удерживаются водородными связями.
Большинство белков содержит как α-спирали, так и β-структуры.
Вторичная структура была установлена американским химиком Л. Полингом в 1951 г.
Третичная структура белка — форма закрученной спирали в пространстве, образованная главным образом за счет дисульфидных мостиков -S-S- , водородных связей, гидрофобных и ионных взаимодействий.
Третичная структура – это трехмерная пространственная конфигурация закрученной α-спирали или β-структуры в пространстве.
У большинства белков полипептидные цепи свернуты особым образом в «клубок» — компактную «глобулу».
Белок в водном растворе свертывается таким образом, чтобы его гидрофобные (водоотталкивающие — от греч. гидро – вода, фобос – страх) боковые цепи были внутри молекулы, а гидрофильные (растворимые) – повернуты наружу.
Третичная структура образуется за счет дисульфидных мостиков -S-S- между цистеиновыми остатками, находящимися в разных местах полипептидной цепи.
В образовании третичной структуры участвуют также ионные взаимодействия противоположно заряженных групп (солевые мостики) NH3+ и COO— .
Интересно знать!
В составе волос содержится белок кератин. В его молекуле имеется большое количество дисульфидных связей. С помощью химической завивки волосам можно придать другую форму. Для этого волосы сначала накручивают на бигуди, затем обрабатывают раствором реагента-восстановителя, разрушающего дисульфидные связи, и прогревают. В результате этого кератин приобретает иную пространственную структуру. Далее волосы промывают и обрабатывают реагентом-окислителем, при этом происходит образование новых дисульфидных связей. Вследствие этого вновь приобретенная структура кератина стабилизируется. Волосы приобретают другую форму.
Четвертичная структура белка — агрегаты нескольких белковых макромолекул (белковые комплексы), образованные за счет взаимодействия разных полипептидных цепей.
Четвертичная структура – способ совместной укладки нескольких полипептидных цепей. Образующиеся структуры называются ассоциатами.
Термин «четвертичная структура» был предложен в 1958 г. Дж. Берналом.
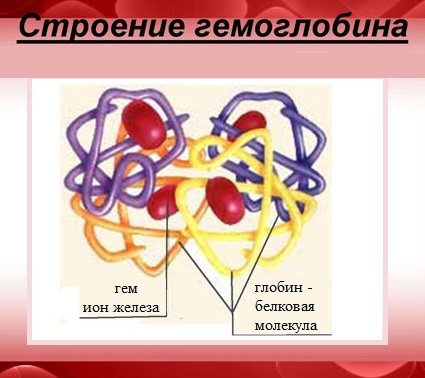
Характерной особенностью белков с четвертичной структурой является их способность к самосборке, например, гемоглобин (белок крови) легко собирается из смеси α- и β-цепей и гема.
Гемоглобин — сложный белок, макромолекула которого состоит из четырех полипептидных цепей (глобул), соединенных с четырьмя гемами – небелковыми образованиями, которые и придают крови красный цвет.
В каждом геме содержится один атом двухвалентного железа, который может непрочно связывать одну молекулу кислорода. В результате такого связывания образуется оксигемоглобин, одна молекула которого переносит к тканям четыре молекулы кислорода.
Из тканей гемоглобин выносит углекислый газ, молекулы которого присоединяются к аминогруппам, содержащимся в полипептидных цепях.
Рубрики: Белки
структура белка
До этого мы разбирали вторичные структуры изолированно, но представьте себе очень длинную полипептидную цепь. Не может же она вся закручиваться в альфа-спираль или становиться бета-складчатой. Хотя иногда и может, но об этом позднее. Чаще всего белок — это комбинация из альфа-спиралей, бета-тяжей и беспорядочных клубков. То есть может это выглядеть примерно вот-так.
Супервторичная структура белка
Поймите, что супервторичная структура белка не стоит выше, чем вторичная. Это просто название, которое неправильно отражает суть, поэтому оно мне не нравится. На западе используют другое название — структурные мотивы, оно намного лучше. Вот в чем его суть: хоть у нас огромное количество самых разных белков, но в них есть определенные повторяющиеся паттерны — это и есть мотивы. Наиболее частые из них: бета-тяж + альфа-спираль + бета-тяж (бета-альфа-бета петля); альфа-спираль + бета-поворот + альфа-спираль; бета-бочонок.
Структурные мотивы
Мотивов очень много, но думаю смысл понятен. Простые мотивы могут объединяться и образовывать мотивы посложнее.
Я использовал в иллюстрациях прошлые картинки, но помните, что эти альфа-спирали и бета-тяжи отличаются друг от друга аминокислотными остатками — они очень разные! Просто перерисовывать все это не хочется.
Вторичная структура ДНК
Наиболее распространённой формой вторичной структуры ДНК является двойная спираль . Эта структура образуется из двух взаимно комплементарных антипараллельных полидезоксирибонуклеотидных цепей, закрученных относительно друг друга и общей оси в правую спираль . При этом азотистые основания обращены внутрь двойной спирали, а сахарофосфатный остов — наружу. Впервые эту структуру описали Джеймс Уотсон и Френсис Крик в 1953 году .
В формировании вторичной структуры ДНК участвуют следующие типы взаимодействий:
- водородные связи между комплементарными основаниями (две между аденином и тимином, три — между гуанином и цитозином);
- стэкинг -взаимодействия;
- электростатические взаимодействия;
В зависимости от внешних условий параметры двойной спирали ДНК могут меняться, причём иногда существенно. Правоспиральные ДНК со случайной нуклеотидной последовательностью можно грубо разделить на два семейства — и В, главное отличие между которыми — конформация дезоксирибозы . К В-семейству также относятся С- и D-формы ДНК . Нативная ДНК в клетке находится в В-форме. Важнейшие характеристики А- и В-форм ДНК приведены в таблице .
| Признак | А-форма | В-форма | Z-форма |
|---|---|---|---|
| Спираль | правая | правая | левая |
| Количество пар оснований на виток | 11 | 10 | 12 |
| Шаг спирали | 28,6 Å | 33,6 Å | 45 Å |
| Диаметр спирали | 23 Å | 20 Å | 18 Å |
| Угол между плоскостями оснований и осью спирали | 70° | 90° | 100° |
| Конформация гликозидной связи | анти | анти | анти (у пиримидина), син (у пурина) |
| Конформация дезоксирибозы | С3’-эндо | С2’-эндо | С2’-эндо (у пиримидина), С3’-эндо (у пурина) |
Необычная форма ДНК была открыта в 1979 году . Рентгеноструктурный анализ кристаллов, образованных гескануклеотидами вида d(CGCGCG), показал что такие ДНК существуют в виде левой двойной спирали. Ход сахарофосфатного остова такой ДНК можно описать зигзагообразной линией, поэтому этот вид ДНК было решено назвать Z-формой . Было показано, что ДНК с определённой последовательностью нуклеотидов может переходить из обычной В-формы в Z-форму в растворе высокой ионной силы и в присутствии гидрофобного растворителя. Необычность Z-формы ДНК проявляется в том, что повторяющейся структурной единицей являются две пары нуклеотидов, а не одна, как во всех других формах ДНК. Параметры Z-ДНК приведены в таблице выше.
Примечания
Wikimedia Foundation
.
2010
.
Смотреть что такое «Вторичная структура» в других словарях:
вторичная структура
— — Тематики энергетика в целом EN secondary structure …
вторичная структура
— antrinė sandara statusas T sritis fizika atitikmenys: angl. secondary structure vok. sekundäre Struktur, f; sekundäres Gefüge, n rus. вторичная структура, f pranc. structure secondaire, f … Fizikos terminų žodynas
вторичная структура
— микро и макроструктура, сформированная в результате термической обработки или пластической деформации металла или сплава; Смотри также: Структура ячеистая структура пластинчатая структура … Энциклопедический словарь по металлургии
Вторичная структура конформационное расположение главной цепи (англ. backbone) макромолекулы (например, полипептидная цепь белка), независимо от конформации боковых цепей или отношения к другим сегментам . В описании вторичной… … Википедия
вторичная структура белка
— – пространственная конфигурация полипептидной цепи, формируемая в результате нековалентных взаимодействий между функциональными группами аминокислотных остатков (α и β структуры белков) …
вторичная структура ДНК
— – пространственная конфигурация молекулы ДНК, стабилизированная за счет водородных связей между комплементарными парами азотистых оснований (см. двойная спираль ДНК) … Краткий словарь биохимических терминов
вторичная структура — палуба и модули на морской платформе
— — Тематики нефтегазовая промышленность EN secondary structure … Справочник технического переводчика
вторичная структура белка
— Укладка полипептидной цепи в альфа спиральные участки и бета структурные образования (слои); в образовании В.с.б. участвуют водородные связи. Тематики… … Справочник технического переводчика
Secondary structure of protein вторичная структура белка. Укладка полипептидной цепи в aльфа спиральные участки и бета структурные образования (слои); в образовании В.с.б. участвуют водородные связи. (
Белки — важный класс биологических макромолекул, содержащиеся во всех биологических организмах, и состоят в основном из углерода, водорода, азота, фосфора, кислорода и серы. Все белки являются полимерами аминокислот. Эти полимеры также известны как полипептиды
и состоят из последовательности 20 различных L-α-аминокислот, также называются аминокислотными остатками. Для цепочек длиной примерно до 40 остатков вместо термина «белок» чаще используется термин «пептид». Чтобы быть способным выполнять свою биологическую функцию, каждый белок принимает одну или более конформации, образующиеся с помощью ряда нековалентных взаимодействий, таких как водородные связи, ионные, вандерваальсивськи и гидрофобные взаимодействия. Для того, чтобы понять функцию белков на молекулярном уровне, часто необходимо определить трехмерную структуру белков. Отрасль биологии, занимающаяся установлением структуры белков, называется структурной биологии и использует такие методы как рентгеноструктурный анализ и ЯМР-спектроскопия.
Число остатков, необходимое для выполнения большинства специфических биохимических функций, составляет около 40-50, что, кажется, является нижней границей размера подавляющего большинства доменов. Размеры белков (но не пептидов) изменяются от этой низшего предела до нескольких тысяч остатков в многофункциональных или структурных белках. Оценка средней длины большинства белков составляет около 300 остатков. Белки также часто формируют белковые комплексы, состоящие из белковых субъединиц, например многие тысячи молекул актина собираются в длинные микрофиламенты.
Вторичная структура РНК
Молекулы РНК представляют собой единичные полинуклеотидные цепи. Отдельные участки молекулы РНК могут соединяться и образовывать двойные спирали
Конформация – это пространственное расположение в органической молекуле замещающих групп, способных свободно изменять свое положение в пространстве без разрыва связей, благодаря свободному вращению вокруг одинарных углеродных связей.
Различают 2 вида вторичной структуры белка:
1.
α
-спираль
2.
β
-складчатость.
Вторичную структуру стабилизируют водородные связи. Водородные связи возникают между атомом водорода в NH группе и карбоксильным кислородом.
Характеристика
α
-спирали.
- α
-спираль стабилизируется водородными связями, которые возникают между каждой первой и четвертой аминокислотой. Шаг спирали включает 3, 6 аминокислотных остатка. - Образование
α
-спирали происходит по часовой стрелке (правый ход спирали), т. к. природные белки состоят из L-аминокислот.
Для каждого белка характерна своя степень спирализации полипептидной цепи. Спирализованные участки чередуются с линейными. В молекуле гемоглобина
α
и
β
-цепи спирализованы на 75%, в лизоциме – 42%, пепсине – 30%.
Степень спирализации зависит от первичной структуры белка.
- α
-спираль образуется самопроизвольно и является наиболее устойчивой конформацией полипептидной цепи, отвечающей минимуму свободной энергии. - В образовании водородных связей участвуют все пептидные группы. Это обеспечивает максимальную стабильность
α
-спирали. - так как все гидрофильные группы пептидного остова обычно участвуют в образовании водородных связей, то гидрофобность альфа спиралей увеличивается.
- радикалы аминокислот находятся на наружной стороне альфа спиралей и направлены от пептидного остова в стороны. Они не участвуют в образовании водородных связей, характерны для вторичной структуры, но некоторые из них могут нарушать формирование альфа спиралей:
- Пролин. Его атом азота входит в состав жесткого кольца, что исключает возможность вращения вокруг N-CH связей. Кроме того, у атома азота пролина, образующего связь с другой аминокислотой нет водорода. В результате пролин не способен организовать водородную связь и структура альфа спиралей нарушается. Обычно здесь возникает петля или изгиб.
- Участки, где последовательно расположены несколько одинаково заряженных радикалов, между которыми возникают электростатические силы отталкивания.
- Участки с близко расположенными обьемными радикалами, механически нарушающими формирование альфа спиралей, например метионин, триптофан.
Спирализации белковой молекулы препятствует аминокислота пролин.
β
— складчатость имеет слабоизогнутую конфигурацию полипептидной цепи.
Если связанные полипептидныые цепи направлены противоположно, возникает антипараллельная
β
-структура, если же N и С концы полипептидных цепей совпадают, возникает структура параллельного
β
-складчатого слоя.
Для
β
-складчатости характерны водородные связи в пределах одной полипептидной цепи или сложных полипептидных цепей.
В белках возможны переходы от
α
-спирали к
β
-складчатости и обратно вследствие перестройки водородных связей.
β
-складчатость имеет плоскую форму.
α
-спираль имеет стержневую форму.
Водородные связи – слабые связи, энергия связи 10 – 20 ккал/моль, но большое количество связей обеспечивает стабильность белковой молекулы.
В молекуле белка имеются прочные (ковалентные) связи, а также слабые, что обеспечивает с одной стороны стабильность молекулы, а с другой лабильность.
Бета-слой вторичной структуры
Вторым типом структурной организации вещества является бета-слой, который представляет собой две и более нити полипептида, соединенные водородной связью. Последняя возникает между свободными CO NH2 группами. Таким образом соединяются, в основном, структурные (мышечные) белки.
Структура белков данного типа такова: одна нить полипептида с обозначением концевых участков А-В параллельно располагается вдоль другой. Единственный нюанс в том, что вторая молекула располагается антипараллельно и обозначается как В-А. Так образуется бета-слой, который может состоять из сколько угодно большого количества полипептидных цепочек, соединенных множественными водородными связями.