Таргетная терапия
Содержание:
- Роли в раке
- Интервальное голодание для женщин: польза или вред
- Структура JAK и STAT
- Ингибиторы mTOR в качестве терапии
- Подтипы
- Биомаркеры
- Долгосрочное потенцирование
- Новые направления в лечении аутосомно-доминантной поликистозной болезни почек
- Как увеличить концентрацию mTOR?
- Что такое таргетная терапия?
- Омоложение без дедифференцировки
- Рапамицин в продлении жизни
- Физические упражнения улучшают память и обучаемость, активируя белок mTOR
- Диагностика
- Диета и здоровый образ жизни
- Заключение
Роли в раке
При раке яичников
Путь PI3K / AKT / mTOR является центральным регулятором рака яичников . Киназы PIM сверхэкспрессируются при многих типах рака, а также способствуют регуляции рака яичников . Было обнаружено, что PIM прямо или косвенно активирует mTOR и его вышестоящие эффекторы, такие как AKT. Кроме того, киназы PIM могут вызывать фосфорилирование IRS, что может изменять PI3K . Это указывает на тесное взаимодействие PIM с каскадом PI3K / AKT / mTOR и его компонентами. Также сообщалось, что AKT выполняет фосфорилирование BAD в клетках OC. PIM и сеть PI3K / AKT / mTOR могут ингибировать экспрессию P21 и P27 в клетках OC. Эти данные указывают на сильную возможность взаимодействия и значимости киназ PIM и сети PI3K / AKT / mTOR в регуляции рака яичников. Однако определение этого пути при раке яичников было сложной задачей, поскольку в нескольких исследованиях не удалось достичь достаточной клинической пользы.
При раке груди
При многих видах рака молочной железы аберрации пути PI3K / AKT / mTOR являются наиболее частыми геномными аномалиями. Наиболее распространенные известные аберрации включают мутацию гена PIK3CA и мутации потери функции или эпигенетическое молчание фосфатазы и гомолога тензина (PTEN). Фосфоинозитид-3-киназа (PI3K) / протеинкиназа B (Akt) / мишень рапамицина (mTOR) млекопитающих активируется примерно в 30-40% случаев РМЖ. В TNBC онкогенная активация пути PI3K / AKT / mTOR может происходить как функция сверхэкспрессии вышестоящих регуляторов, таких как EGFR , активирующих мутаций PIK3CA , потери функции или экспрессии фосфатазы и гомолога тензина (PTEN) и богатого пролином полифосфатазы инозитола, которые являются ингибиторами PI3K. Это согласуется с гипотезой о том, что ингибиторы PI3K могут преодолевать резистентность к эндокринной терапии, когда она приобретается.
При уротелиальном раке
PIK3CA часто имеет функциональные мутации при уротелиальном раке. Подобно PI3Ka, PI3Kb экспрессируется во многих различных клетках и в основном участвует в активации тромбоцитов и развитии тромботических заболеваний. Исследования показали, что PI3Kb также способствует пролиферации опухолей. В частности, он играет важную роль в онкогенезе при PTEN- негативных злокачественных опухолях. Сообщается, что вмешательство в ген PI3Kb может быть терапевтическим подходом к высокому риску рака мочевого пузыря с мутантным PTEN и потерей E-кадгерина . Специфические ингибиторы изоформ PI3Kb являются потенциальным средством лечения рака с дефицитом PTEN.
При раке простаты
Путь PI3K является основным источником лекарственной устойчивости при раке простаты . Это особенно верно в отношении кастратрезистентного рака предстательной железы, когда опухоли становятся устойчивыми к терапии по депривации андрогенов , что блокирует способность опухолей использовать гормон андроген для роста. Это связано со сложным механизмом обратной связи, который существует между рецептором андрогена и путем PI3K. Как и в случае с другими типами опухолей, мутации в ключевых генах этого пути могут приводить к гиперактивации этого пути, например, в PIK3CA. Увеличение числа копий PIK3CA и повышенная экспрессия мРНК также, среди прочего, увеличивает активацию пути при раке простаты. Было показано, что прирост в соседней генетической области 3q26.31-32 происходит совместно с рядом ближайших членов семейства PI3K, включая PIK3CA , PIK3CB и PIK3R4 , что приводит к транскрипционным изменениям в PIK3C2G , PIK3CA, PIK3CB, PIK3R4, а также в связанных с ними путях. с пролиферацией клеток . Эти большие увеличения охвата ассоциируются со степенью Глисона , стадией опухоли , метастазами в лимфатические узлы и другими агрессивными клиническими особенностями. У пациентов, получавших ингибиторы PI3K, пациенты с увеличением числа копий в PIK3CB, по- видимому, имели повышенную лекарственную чувствительность.
Интервальное голодание для женщин: польза или вред
В чем же именно заключается польза интервального голодания и почему эта система похудения так популярна сегодня?
Интервальное голодание ускоряет межклеточные процессы в организме и способствует быстрой выработке гормонов. Когда наш организм не получает пищи, то в его работе происходит целый ряд изменений: уровень инсулина в крови падает, что способствует процессам жиросжигания, вырабатывается гормон роста, который также отвечает за сжигание жира и за наращивание мышечной массы. На межклеточном уровне запускаются механизмы, которые приводят к более быстрому обновлению клеток. Все эти процессы благотворно сказываются не только на общем физическом состоянии человека.
- ИГ приводит к потере веса. Одно из преимуществ всех процессов, которые происходят во время голодания, — это потеря веса. В основном это достигается за счет того, что организм начинает активно сжигать жиры, которые до этого аккумулировал и не тратил. Это вполне объяснимо, ведь в большинстве случаев человек не успевает потратить даже ту энергию, которую получил вместе с пищей в течение дня, не говоря уже о жировых запасах. Как ни крути, а во время ИГ происходит значительное урезание своего рациона и вы потребляете в разы меньше еды. Все это приводит к дефициту калорий, а чтобы восполнить этот дефицит, организм будет задействовать уже имеющиеся жировые запасы.
- Повышается уровень метаболизма. Уже было доказано, что голодание способно ускорить уровень обмена веществ на 3%-14%. А это так же в свою очередь способствует активному сжиганию калорий, что приводит к похудению. Примечателен тот факт, что большинство людей, которые сумели похудеть, придерживаясь ИГ, сумели избавиться от лишнего веса именно в зоне талии и живота. Считается, что скопления жира в этих зонах — это признак замедленного метаболизма, вот почему от этих проблемных мест очень сложно избавиться, придерживаясь обычной диеты.
- Интервальное голодание не вызывает такой потери мышечной массы, как, например, строгие диеты или подсчет калорий. Было доказано, что во время голодания активно работает гормон роста, который и отвечает за мышечную массу в организме человека.
- Голодание также повышает устойчивость организма к стрессу и различным воспалительным процессам. Особенно это касается окислительного стресса, который разрушает клетки организма и повышает уровень свободных радикалов, которые ускоряют процессы старения организма. Не зря голодание применяют также для продления молодости организма и кожи.
- Интермиттент фастинг значительно снижает риски различных сердечно-сосудистых заболеваний. Здесь речь идет и повышенном давлении, ишемической болезни сердца, сердечной недостаточности.
- Одно из главных преимуществ интервального голодания заключается в уменьшении риска заболеть диабетом 2 типа. Этот вид диабета стал очень распространенным в последнее время и врачи призывают пересмотреть свой образ жизни, чтобы не допустить этого заболевания. Понижение уровня инсулина в крови и является защитой от диабета. Так, доктор Джейсон Фанг считает, что ИГ способно купировать диабет на ранней стадии.
Помимо уже вышеприведенных преимуществ, следует также упомянуть, что ИГ улучшает работу мозга, повышает работоспособность, а также заряжает энергией.
В чем же вред ИГ? Как и в любой системе питания, здесь есть свои За и Против, но самое важное это то, что все индивидуально! Кому-то эта методика не подходит из-за уже имеющихся хронических заболеваний, а кто-то просто не может выдержать такого промежутка между приемами пищи. ИГ — это система питания, которая имеет своих почитателей и критиков
К кому вы присоединитесь, решать только вам!
Структура JAK и STAT
Основные статьи: JAK и STAT
Существует четыре белка JAK: JAK1 , JAK2 , JAK3 и TYK2 . JAK содержит домен FERM (приблизительно 400 остатков), SH2-родственный домен (приблизительно 100 остатков), киназный домен (приблизительно 250 остатков) и псевдокиназный домен (приблизительно 300 остатков). Киназный домен жизненно важен для активности JAK, поскольку он позволяет JAK фосфорилировать (добавлять к ним фосфатные группы) белки.
Существует семь белков STAT: STAT1 , STAT2 , STAT3 , STAT4 , STAT5A , STAT5B и STAT6 . Белки STAT содержат много разных доменов, каждый из которых выполняет свою функцию, из которых наиболее консервативной областью является домен SH2 . Домен SH2 образован 2 α-спиралями и β-листом и образован приблизительно из остатков 575–680. STAT также имеют домены активации транскрипции (TAD), которые менее консервативны и расположены на С-конце. Кроме того, STAT также содержат: активационный тирозин, аминоконцевой, линкерный, спиральный и ДНК-связывающий домены .
Ингибиторы mTOR в качестве терапии
Болезнь накопления гликогена
В некоторых статьях сообщалось, что рапамицин может ингибировать mTORC1, так что фосфорилирование GS (гликогенсинтазы) может увеличиваться в скелетных мышцах. Это открытие представляет собой потенциальный новый терапевтический подход к болезни накопления гликогена, которая включает накопление гликогена в мышцах.
Противораковые
Для лечения рака человека используются два основных ингибитора mTOR: темсиролимус и эверолимус . Ингибиторы mTOR нашли применение при лечении различных злокачественных новообразований, включая почечно-клеточную карциному (темсиролимус) и рак поджелудочной железы , рак груди и почечно-клеточную карциному (эверолимус). Полный механизм этих агентов не ясен, но считается , что они функцией, ослабляя опухоль ангиогенез и вызывая ухудшение в / переходе G1 S .
Против старения
Ингибиторы mTOR могут быть полезны для лечения / профилактики некоторых возрастных состояний, включая нейродегенеративные заболевания, такие как болезнь Альцгеймера и болезнь Паркинсона . После кратковременного лечения ингибиторами mTOR дактолизибом и эверолимусом у пациентов пожилого возраста (65 лет и старше) в течение года наблюдалось снижение числа инфекций.
Сообщалось, что различные природные соединения, включая галлат эпигаллокатехина (EGCG), кофеин , куркумин , берберин , кверцетин , ресвератрол и птеростильбен , ингибируют mTOR при нанесении на изолированные клетки в культуре. Пока нет высококачественных доказательств того, что эти вещества подавляют передачу сигналов mTOR или увеличивают продолжительность жизни при приеме людьми в качестве пищевых добавок , несмотря на обнадеживающие результаты у таких животных, как дрозофилы и мыши. Различные испытания продолжаются.
Подтипы
Существование множества типов рецепторов дофамина было впервые предложено в 1976 году. Существует по крайней мере пять подтипов рецепторов дофамина: D 1 , D 2 , D 3 , D 4 и D 5 . Рецепторы D 1 и D 5 являются членами D 1- подобного семейства дофаминовых рецепторов, тогда как рецепторы D 2 , D 3 и D 4 являются членами D 2- подобного семейства . Есть также некоторые свидетельства, которые предполагают существование возможных рецепторов допамина D 6 и D 7 , но такие рецепторы окончательно не идентифицированы.
На глобальном уровне рецепторы D 1 широко экспрессируются по всему мозгу. Кроме того, подтипы рецепторов D 1-2 обнаруживаются в 10–100 раз больше, чем подтипы D 3-5 .
D 1 -подобная семья
В D 1 -подобного семейство рецепторов связаны с G белком G sα . D 1 также связан с G olf .
G sα впоследствии активирует аденилатциклазу , увеличивая внутриклеточную концентрацию вторичного мессенджера циклического аденозинмонофосфата (цАМФ).
- D 1 кодируется геном дофаминового рецептора D 1 ( ).
- D 5 кодируется геном дофаминового рецептора D 5 ( ).
D 2- подобная семья
В D 2 -подобного семейство рецепторов связаны с G белком G iα , который непосредственно ингибирует образование сАМР путем ингибирования фермента аденилатциклазы.
-
D 2 кодируется геном дофаминового рецептора D 2 ( ), из которого существует две формы: D 2 Sh (короткий) и D 2 Lh (длинный):
- Форма D 2 Sh находится пресинаптически и имеет модуляторные функции (а именно, ауторецепторы , которые регулируют нейротрансмиссию через механизмы обратной связи . Она влияет на синтез, хранение и высвобождение дофамина в синаптическую щель ).
- Форма D 2 Lh может функционировать как классический постсинаптический рецептор, т. Е. Передавать информацию (возбуждающим или ингибирующим образом), если она не блокируется антагонистом рецептора или синтетическим частичным агонистом .
- D 3 кодируется геном дофаминового рецептора D 3 ( ). Максимальная экспрессия дофаминовых D 3 -рецепторов отмечается на островах Calleja и прилежащем ядре .
- D 4 кодируется геном дофаминового рецептора D 4 ( ). В D 4 гена рецептора показывает полиморфизмы , которые отличаются в числе переменного тандемного повтор , присутствующий в кодирующей последовательности в экзоне 3. Некоторые из этих аллелей связаны с большей частотой некоторых расстройств. Например, аллели D 4.7 имеют установленную связь с синдромом дефицита внимания с гиперактивностью .
Рецепторные гетеромеры
Было показано, что дофаминовые рецепторы гетеромеризуются с рядом других рецепторов, связанных с G-белком . В частности, рецептор D2 считается основным узлом в сети гетеромеров GPCR . Протомеры состоят из
- D 1 –D 2
- D 1 –D 3
- D 2 –D 3
- D 2 –D 4
- D 2 –D 5
Неизорецепторы
- D 1 — аденозин A 1
- D 2 — аденозин A 2A
- D 2 — рецептор грелина
- D 2sh — TAAR1 ( ауторецепторный гетеромер)
- D 4 — адренорецептор α 1B
- D 4 — адренорецептор β 1
Биомаркеры
Идентификация прогностических биомаркеров эффективности для типов опухолей, чувствительных к ингибиторам mTOR, остается серьезной проблемой. Возможными прогностическими биомаркерами на ингибиторы mTOR, как было описано для глиобластомы , клеток рака груди и простаты , может быть дифференциальная экспрессия белков пути mTOR, PTEN , AKT и S6. Таким образом, эти данные основаны на доклинических исследованиях, основанных на культивируемых in vitro линиях опухолевых клеток, которые предполагают, что эффекты ингибиторов mTOR могут быть более выраженными при раке, демонстрирующем потерю функций PTEN или мутации PIK3CA . Однако использование PTEN, мутаций PIK3CA и AKT-фосфо-статуса для прогнозирования чувствительности к рапалогу не было полностью подтверждено в клинике. На сегодняшний день попытки идентифицировать биомаркеры ответа рапалога не увенчались успехом.
Чувствительность
Клинические и трансляционные данные показывают, что чувствительные типы опухолей с адекватными параметрами и функциональными путями апоптоза могут не нуждаться в высоких дозах ингибиторов mTOR для запуска апоптоза. В большинстве случаев раковые клетки могут быть только частично чувствительны к ингибиторам mTOR из-за избыточной передачи сигнала или отсутствия функциональных сигнальных путей апоптоза. В подобных ситуациях могут потребоваться высокие дозы ингибиторов mTOR. В недавнем исследовании пациентов с почечно-клеточной карциномой устойчивость к темсиролимусу была связана с низкими уровнями p-AKT и p-S6K1, которые играют ключевую роль в активации mTOR. Эти данные убедительно свидетельствуют о количестве опухолей с активированным сигнальным путем PI3K / AKT / mTOR, которые не реагируют на ингибиторы mTOR. Для будущих исследований рекомендуется исключить пациентов с низким или отрицательным уровнем p-AKT из испытаний с ингибиторами mTOR.
Текущих данных недостаточно для прогнозирования чувствительности опухолей к рапамицину. Однако имеющиеся данные позволяют охарактеризовать опухоли, которые могут не реагировать на рапалоги.
Долгосрочное потенцирование
Для того, чтобы произошло долгосрочное потенцирование (ДП), должна быть стимуляция рецепторов NMDA , которая заставляет рецепторы AMPA вставляться постсинаптически . PI3K связывается с рецепторами AMPA в консервативной области, чтобы ориентировать рецепторы в мембране, особенно в субъединице GluR. Активность PI3K увеличивается в ответ на ионы кальция и СаМ . Кроме того, AKT локализует PtdIns-3Ps в постсинапсе, который рекрутирует стыковочные белки, такие как tSNARE и Vam7. Это напрямую приводит к стыковке AMPA в постсинапсе. mTOR активировал p70S6K и инактивировал 4EBP1, который изменяет экспрессию гена, чтобы позволить LTP возникать. Длительная тренировка условного рефлекса страха у крыс влияла, но не оказывала никакого эффекта на краткосрочное кондиционирование. В частности, была потеряна обусловленность страха миндалевидного тела. Это тип следовой обусловленности, которая представляет собой форму обучения, которая требует ассоциации условного стимула с безусловным стимулом. Этот эффект терялся при нокдаунах PI3K и усиливался при сверхэкспрессии PI3K.
Новые направления в лечении аутосомно-доминантной поликистозной болезни почек
Успехи в понимании причин, развития и прогрессирования АДПКП привели исследователей к изучению новых вариантов терапии данного заболевания. Новые методы лечения включают в себя препараты, блокирующие активность вазопрессина (антагонисты вазопрессина), препарат, ингибирующий активность определенных гормонов (соматостатин), и препараты, блокирующие активность белка под названием mTOR (антагонисты mTOR).
- Вазопрессин. Это антидиуретический гормон, используемый почками для управления водным балансом в организме. Антагонисты вазопрессина, такие как толваптан, значительно уменьшили развитие кисты в различных животных моделях кистозной болезни почек, включая АДПКП2. Контролируемое клиническое исследование показало, что толваптан замедляет скорость увеличения размеров почек, и снижает скорость снижения функции почек у пациентов с умеренно прогрессирующим заболеванием. Препарат применяется, но зарегестрирован не во всех странах. Употребление дополнительного количества воды в течение дня подавляет уровень вазопрессина в плазме крови и увеличивает мочеиспускание. Таким образом, употребление дополнительной простой воды имеет потенциал для улучшения прогрессирования заболевания, аналогичного блокаде рецепторов вазопрессина V2 в собирательных протоках. Рекомендуется, чтобы дети и взрослые с АДПКП часто пили воду во время игр или занятий спортом в жаркую погоду.
- Октреотид. Длительно действующая форма соматостатина, замедляет рост поликистозных почек у некоторых лиц с АДПКП. Октреотид также замедляет рост печени у лиц с сопутствующей поликистозной болезнью печени. Пока для лечения аутосомно-доминантного поликистоза почек не применяется. Необходимы дополнительные исследования для определения долгосрочной безопасности и эффективности этой потенциальной терапии АДПКБП.
- Антагонисты mTOR. Ученые также исследуют препараты, блокирующие активность mTOR (антагонисты mTOR). mTOR – это белок, который участвует в различных химических процессах организма, включая рост и пролиферацию клеток. mTOR расшифровывается как “мишень рапамицина млекопитающих”. Антагонисты mTOR, такие как Сиролимус, изучаются для применения в качестве патогенетической терапии у людей с АДПКП. Результаты пока противоречивые, но исследований немного и они продолжаются.
- Правастатин (относится к гиполипидемическим препаратам, ингибиторам ГМГ-КоА редуктазы). Правастатин снижает уровень холестерина в крови, улучшает состояние сосудов (сосудистой стенки), реологию крови, обладает антипролиферативным свойством, снижает скорость увеличения размеров почек у детей с АДПКП. Прежде чем назначать пациентам это средство, необходимо провести исследования функции печени.
Как увеличить концентрацию mTOR?
Пока ученые бьются над тем, чтобы создать препарат повышающий концентрацию и активность mTOR, у нас уже есть в арсенале пара-тройка рабочих методов.
- Механическое повреждение
- Анаболические гормоны
- Аминокислоты
- Энергетические запасы
- Оксидативный стресс
Остановимся на каждом чуть подробнее.
Механическое повреждение
Механическое повреждение мышечных волокон в процессе тренировки напрямую увеличивает концентрацию mTOR. Причем, чем больше будет вес и/или интенсивнее нагрузка, тем на большее количество mTOR ты можешь рассчитывать.
Это правило работает лишь по отношению к сравнительно коротким интенсивным тренировкам — 45-60 минут длиной. Превышение этого лимита может негативно сказаться на активации mTOR и процессе синтеза протеина в целом.
Анаболические гормоны
Второй фактор активации mTOR — анаболические гормоны. Среди них ключевую роль играет тестостерон, который, к слову, также повышается во время высокоинтенсивной тренировки с высокими рабочими весами и активацией сразу нескольких мышечных групп. Так что соблюдение всех этих правил будет косвенно влиять на продукцию mTOR.
Аминокислоты
Ключевую роль в продукции mTOR играет аминокислота лейцин, которая входит в число незаменимых и является одной из четырех в составе BCAA. Она оказывает самое заметное влияние на величину mTOR, а заодно служит строительным материалом для новых мышечных клеток.
Энергетические запасы клеток
Один из важнейших факторов активности mTOR — энергетические запасы внутри клеток. Именно по этой причине голодовка или диета с урезанным количеством калорий будет работать против mTOR и процесса синтеза протеина.
Особенно важную роль играют здесь углеводы и накопленные благодаря им запасы гликогена в печени. Если последний будет на исходе, активность mTOR будет стремиться к нулю. Вот почему слишком долгая силовая тренировка или кардио на марафонские дистанции едва ли будут работать на прирост мышечной массы.
Оксидативный стресс
А это, пожалуй, самый интересный пункт программы. Оказывается, оксидативный стресс во время аэробных нагрузок может также оказывать положительное влияние на mTOR. Именно этим фактом ученые объясняют взрывной рост мышечной массы у молодых спортсменов, занимающихся плаванием или бегом.
Вывод — включение кардио в программу может благоприятно сказаться на мышечной при условии, что это будут сравнительно короткие интенсивные нагрузки, например, по протоколу HIIT.
Что такое таргетная терапия?
Таргетная терапия – это специальные лекарства, которые уничтожают определенные типы раковых клеток. Они воздействуют исключительно на вещества, благодаря которым некоторые виды онкологии растут и распространяются по организму.
Название метода происходит от английского слова «target» – цель или мишень. Именно так он и работает – точно против измененных тканей.
Чем таргетная терапия отличается от химиотерапии?
Подобные вещества, так же как и другие используемые для лечения рака лекарства, технически считаются химиотерапией, но принцип их действия отличается:
- Благодаря своему целенаправленному действию, данные средства воздействуют на онкологические клетки и практически не повреждают здоровые. Стандартная же «химия» цитотоксична – ядовита не только для опухолевых, но и для нормальных клеток.
- Обычные препараты уничтожают уже образовавшиеся измененные клетки, таргетные же блокируют их копирование, предотвращают деление и создание новых.
Омоложение без дедифференцировки
Разными группами ученых были проведены эксперименты, доказавшие возможность омоложения клетки без утраты её специфичности. Более того, к настоящему моменту описано уже три основных способа заставить клетку «вспомнить молодость» :
- Создание «молодого окружения».
- Воздействие на определенные гены.
- Фармакологическое воздействие на клетки.
Первый способ: создание «молодого окружения»
Чтобы понять, способны ли клетки и ткани старой мыши омолодиться под воздействием внешних биологических факторов, был использован гетерохронический парабиоз (ГП) — метод, при котором две мыши — молодая и старая — сшиваются боками (как сиамские близнецы; рис. 2). При этом у мышей создают общую кровеносную систему и пул крови. Супруги Конбой (Irina Conboy и Michael Conboy) еще в 2005 году продемонстрировали, что при ГП к клеткам мышц и печени старой мыши возвращается юность. Они приобретают фенотип молодых клеток, а молекулярные метки старения пропадают , . Восстанавливают свой потенциал и тканеспецифичные стволовые клетки мышц. Конбой сообщают, что даже очень старые стволовые клетки не теряют своих способностей восстанавливать и поддерживать ткань, просто надо обеспечить им молодое окружение .
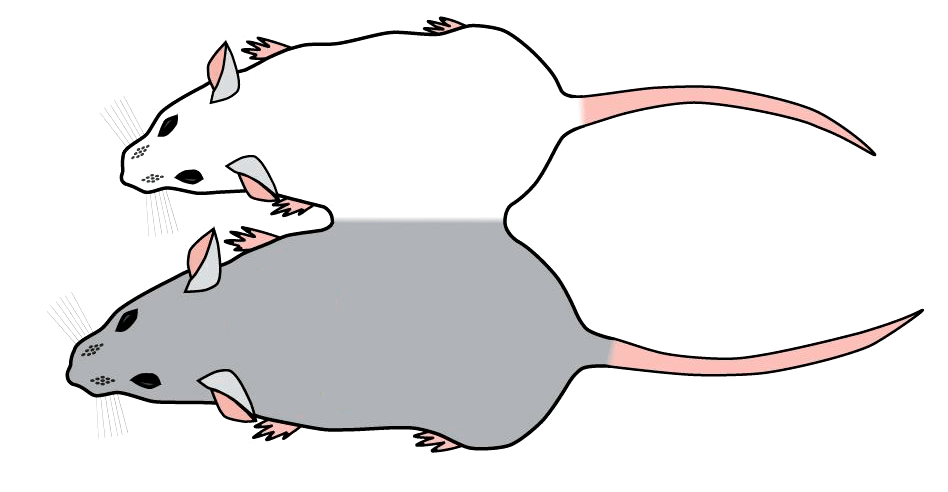
Рисунок 2. Модель гетерохронического парабиоза. Мышей сшивают, создавая единую кровеносную систему.
В 2014 году Гарвардские биологи, используя ГП, выявили ростовой фактор дифференцировки 11 (grow differentiation factor 11, или GDF 11). Журнал Science назвал эту работу первой демонстрацией фактора омоложения, так как GDF11 обладает всеми необходимыми характеристиками: он синтезируется в организме, обращает старение вспять в большинстве тканей и его уровень снижается с возрастом .
Биологи из Стэнфорда тоже исследовали модель ГП. Они сосредоточились на эффектах, возникающих при воздействии молодой крови на мозг. Выяснилось, что в определенных областях мозга мыши повысился нейрогенез и уровень пролиферации стволовых клеток, то есть стали появляться новые нейроны, которые в норме появляются только у молодых особей , . Интересно, что во всех экспериментах с ГП молодые мыши стареют.
Механизмы описанных выше эффектов на сегодняшний день до конца не ясны. Ученые предполагают, что в эти процессы вовлечены как стволовые клетки, так и различные ростовые факторы, цитокины и др.
Третий способ: фармакологическое воздействие на клетки
Таким образом, разделить процессы старения и дифференцировки возможно. Осталось только разобраться, чем же различаются механизмы «обнуления» клеток и их омоложения.
Рапамицин в продлении жизни

Лекарства, которые назначают для лечение возраст-ассоциированных заболеваний — таких как гипертония, диабет, рак простаты, похожи на антивозрастные вещества своим ингибирующим действием на гиперфункцию клеток, запускаемую с помощью mTOR.
Так, метформин, который выписывают диабетикам, продлевает жизнь мышей и червей. Аспирин снижает риск тромбоза и рака пищеварительной системы.
Считается, что рапамицин проявляет свои свойства продления жизни, имитируя эффект ограничения калорийности, один из самых надежных способов продления жизни у животных. Он нацелен на сигнальную молекулу mTOR, которая является важным узлом в путях восприятия питательных веществ. Отсутствие еды выключает mTOR и активирует аварийные системы, которые позволяют нам пережить периоды голода.
Эти пути запускают аутофагию, процесс, с помощью которого клетки поглощают дисфункциональные органеллы и молекулы для получения энергии. Это уменьшает накопление мертвого органического материала, который обычно забивает наши ткани по мере того, как мы стареем, и, следовательно, замедляет или даже обращает вспять процесс старения.
Считается, что проведение клинических испытаний рапамицина на людях практически невозможно — для выявления каких-либо эффектов долголетия потребуются десятилетия.
К сожалению, лекарство, подобное рапамицину, предназначенное для предотвращения респираторных заболеваний у пожилых пациентов, не прошло клинические испытания. Препарат рано показал себя многообещающим, и считалось, что он действует, замедляя иммунное старение или возрастное снижение иммунной системы. Однако многие другие ингибиторы mTOR находятся в стадии разработки.
Физические упражнения улучшают память и обучаемость, активируя белок mTOR
Известно, что физические упражнения оказывают благотворное влияние на память и способность к обучению, в том числе сложным двигательным навыкам. Несмотря на активное проведение исследований в этой области, все молекулярные механизмы влияния физической активности на когнитивные функции пока не выяснены. Сейчас ученые из Китая обнаружили еще один из таких механизмов
Известно, что физические упражнения усиливают экспрессию гена, кодирующего нейротрофический фактор мозга (BDNF). Этот белок стимулирует и контролирует развитие нейронов, а также способен активировать mTOR-киназу, белок, известный как «мишень рапамицина».
Фермент mTOR участвует во множестве клеточных процессов, включая дифференцировку клеток, апоптоз и аутофагию, старение, а подавление активности mTOR рапамицином продлевает жизнь многих организмов. С другой стороны, активация mTOR-киназы способствует процессам синаптической передачи и миелинизации аксонов нервных клеток и усиливает дендритную пластичность, – изменение количества дендритных шипиков, мембранных выростов на отростках-дендритах нейрона. Эти процессы являются ключевыми для формирования памяти и обучения, в том числе, моторной памяти. Исследователи предположили, что сигнальный путь mTOR-киназы играет роль посредника между выполнением физических упражнений и активацией когнитивных функций мозга, тем более что он еще и активируется в ответ на физическую нагрузку в скелетных мышцах.
Статья Chen et al. Exercise training improves motor skill learning via selective activation of mTOR опубликована в журнале Science Advances.
Ученые провели эксперименты на лабораторных мышах, которых заставляли бегать по беговой дорожке. В ходе тренировок у животных усиливалось образование дендритных шипиков и постсинаптическая возбудимость, утолщалась миелиновая оболочка аксонов. А эксперименты с ингибированием mTOR-киназы рапамицином показали, что у мышей-бегунов, которые получали рапамицин, активирующего действия упражнений не было. Из этого ученые сделали вывод о том, что активация сигнального пути mTOR-киназы в моторной коре головного мозга важна для обучения двигательным навыкам (у человека это было бы улучшение плавности и точности движений, необходимых для занятий, к примеру, танцами и музыкой).

Рисунок из пресс-релиза Jinan University Researchers elucidate mechanism between exercise and improved motor learning – ВМ.
Исследования процессов энергетического обмена показали, что активация сигнального пути mTOR помогает удовлетворить повышенную при физических нагрузках потребность в энергии, но ингибирование mTOR-киназы рапамицином приводит к недостаточному снабжению энергией тканей головного мозга, что неблагоприятно сказывается на жизнедеятельности нервных клеток. При этом, у мышей, которые получали рапамицин, но не бегали, клетки мозга функционировали нормально. То есть активация mTOR необходима для усиления дендритной пластичности при физических нагрузках, но функционировать на базовом уровне ее ингибирование не мешает. Однако этот факт заставляет задуматься, так ли хороша мысль о продлении жизни с помощью ингибирования mTOR, по крайней мере, для любителей активного образа жизни.
Портал «Вечная молодость « http://vechnayamolodost.ru
Диагностика
Биопсия ткани — это предпочтительный метод диагностики. Из-за высокой частоты поражения лимфатических узлов часто выполняется биопсия сторожевого лимфатического узла . Общей характеристикой эпителиоидной саркомы (наблюдаемой в 80% всех случаев) является потеря функции гена SMARCB1 (также называемого BAF47, INI1 или hSNF5). Иммуногистохимическое окрашивание INI1 доступно и может использоваться для диагностики эпителиоидной саркомы. МРТ — это предпочтительный метод диагностики для визуализации перед биопсией и патологической диагностикой, при этом основная роль заключается в определении анатомических границ.
Постановка
Стадия эпителиоидной саркомы учитывает размер и расположение первичной опухоли, поражение лимфатических узлов, наличие и расположение метастазов, а также гистологический класс (показатель агрессивности заболевания).
Диета и здоровый образ жизни
Исследования показали, что модификация образа жизни не просто полезна, а необходима при АДПКП. Не доказано, что какая-либо конкретная диета улучшает прогрессирование заболевания, однако врачи рекомендуют людям с АДПКП избегать продуктов и напитков, содержащих кофеин, ограничивать количество белка и уменьшать количество соли в рационе. Рацион должен быть обогащен фруктами и овощами, чтобы обеспечить достаточное количество калия и уменьшить потребление кислотообразующих продуктов.
Также рекомендуется:
- заниматься физическими упражнениями столько, сколько позволяет время и силы, но избегать агрессивных видов спорта;
- не курить;
- отказаться от алкоголя;
- пить дополнительную воду в течение дня. Взрослым рекомендуется выпивать 3 литра в день, а детям – пропорционально меньше.
Заключение
Опыты по омоложению клеток, как и выявление фактора омоложения GDF11, безусловно, впечатляют. Может показаться, что эликсир молодости вот-вот будет изобретен. Но, к сожалению, не так всё просто. Сделанные на сегодняшний день открытия — это лишь самые первые шаги. Ученые далеки от полного понимания механизмов старения и того, каким образом его можно контролировать/регулировать. Не стоит также забывать, что эксперименты проводились на мышах. Будет ли действовать тот же фактор GDF 11 на человека — неизвестно. И, наконец, существует вероятность, что мобилизация стволовых клеток у старых людей инициирует возникновение злокачественных опухолей или других побочных эффектов. Поэтому, если вам предложат омоложения ради испить «настойки из молодой крови» или «коктейль из стволовых клеток», не спешите. Клиники молодости едва ли появятся в ближайшие десять лет. Но если вы хотите быть молодым и крепким уже сейчас, следуйте примеру Джеффри Лайфа (рис. 4), действуйте по-старинке: занимайтесь спортом, бегайте, ешьте овощи и фрукты. Организм перед вами в долгу не останется.

Рисунок 4. Джеффри Лайф, 74-летний бодибилдер. Начал заниматься спортом только в 57 лет. Сейчас он выглядит значительно лучше, чем почти 20 лет назад.






