Гликолиз в мышечных волокнах
Содержание:
В каких случаях нужно сдавать анализы на гормоны
Если баланс эндокринной системы нарушается, в организме развиваются изменения. Нередко достаточно предельно малых отклонений от нормы, чтобы запустить патологический процесс.
Достаточно долго такие патпроцессы могут протекать бессимптомно. Когда же появляется симптоматика, то нередко патогенез уже необратим. Чтобы выявлять бессимптомные гормональные нарушения на ранних стадиях современная доказательная медицина настоятельно рекомендует пакетные проверки. Один раз в 6-12 месяцев достаточно сдать кровь на анализ, чтобы оценить состояние эндокринной системы и не допустить развития гормональных заболеваний.
Кроме этого, о необходимости сдать анализ на гормоны может свидетельствовать ряд признаков:
- увеличение массы тела;
- бесплодие;
- нарушение функций внутренних органов;
- расстройства либидо;
- подозрение на наличие новообразований;
- избыточный рост волос на лице или теле;
- угревая болезнь;
- нарушения менструального цикла у женщин.
Также обязательно контролировать уровень гормонов при беременности, чтобы не допустить аномалий развития плода.
При планировании беременности необходимо пройти обследование щитовидной железы: сделать УЗИ щитовидной железы, пройти исследования гормонов ТТГ, Т4 свободный (свободный тироксин) и АТ к ТПО (антитела к тиреопероксидазе)
Во время беременности, если есть нарушение функций щитовидной железы, необходимо 1 раз в триместр проводить скрининг гормона ТТГ и консультироваться у эндокринолога.
При запущенных нарушениях баланса гормонов в организме развиваются системные изменения вплоть до инвалидности.
Путь
Глюконеогенез — это путь, состоящий из серии из одиннадцати реакций, катализируемых ферментами. Путь начинается в печени или почках, в митохондриях или цитоплазме этих клеток, это зависит от используемого субстрата. Многие реакции являются обратными шагам, описанным в гликолиз.
- Глюконеогенез начинается в митохондриях с образования оксалоацетата путем карбоксилирования пирувата. Для этой реакции также требуется одна молекула АТФ, и катализируется пируваткарбоксилаза. Этот фермент стимулируется высоким уровнем ацетил-КоА (произведено в β-окисление в печени) и ингибируется высоким уровнем АДФ и глюкозы.
- Оксалоацетат восстанавливается до малат с помощью НАДН, шаг, необходимый для его транспортировки из митохондрий.
- Малат окисляется до оксалоацетата с помощью НАД.+ в цитозоле, где проходят остальные стадии глюконеогенеза.
- Оксалоацетат декарбоксилируется, а затем фосфорилируется с образованием фосфоенолпируват используя фермент PEPCK. Молекула GTP гидролизуется до ВВП во время этой реакции.
- Следующие шаги в реакции такие же, как и в обратном порядке. гликолиз. Тем не мение, фруктозо-1,6-бисфосфатаза обращает фруктозо-1,6-бисфосфат к фруктозо-6-фосфат, используя одну молекулу воды и высвобождая один фосфат (при гликолизе, фосфофруктокиназа 1 конвертирует F6P и АТФ до F1,6BP и ADP). Это также лимитирующая стадия глюконеогенеза.
- Глюкозо-6-фосфат сформирован из фруктозо-6-фосфат к фосфоглюкоизомераза (обратный этапу 2 при гликолизе). Глюкозо-6-фосфат можно использовать в других метаболических путях или дефосфорилировать до свободной глюкозы. В то время как свободная глюкоза может легко диффундировать в клетку и из клетки, фосфорилированная форма (глюкозо-6-фосфат) заблокирована в клетке — механизм, с помощью которого клетки контролируют внутриклеточные уровни глюкозы.
- Окончательный глюконеогенез, образование глюкозы, происходит в просвет из эндоплазматический ретикулум, где глюкозо-6-фосфат гидролизуется глюкозо-6-фосфатаза для производства глюкозы и высвобождения неорганического фосфата. Как и два предыдущих шага, этот шаг не является простым обращением гликолиза, при котором гексокиназа катализирует превращение глюкозы и АТФ в G6P и ADP. Глюкоза перемещается в цитоплазму за счет переносчики глюкозы расположен в мембране эндоплазматического ретикулума.
| Метаболизм общего моносахариды, включая гликолиз, глюконеогенез, гликогенез и гликогенолиз |
|---|
 |
Прекурсоры

Катаболизм протеиногенные аминокислоты. Аминокислоты классифицируются в зависимости от способности их продуктов вступать в глюконеогенез:
- Глюкогенные аминокислоты иметь эту способность
- Кетогенные аминокислоты не. Эти продукты все еще можно использовать для кетогенез или же липидный синтез.
- Некоторые аминокислоты катаболизируются как в глюкогенные, так и в кетогенные продукты.
У человека основными предшественниками глюконеогенных веществ являются: лактат, глицерин (который является частью триацилглицерин молекула), аланин и глутамин. В общей сложности на них приходится более 90% общего глюконеогенеза.Другой глюкогенные аминокислоты и все цикл лимонной кислоты промежуточные продукты (через преобразование в оксалоацетат) также может функционировать как субстрат для глюконеогенеза. Как правило, употребление человеком глюконеогенных субстратов с пищей не приводит к усилению глюконеогенеза.
В жвачные животные, пропионат является основным глюконеогенным субстратом. У нежвачных животных, включая людей, пропионат возникает в результате β-окисления жирных кислот с нечетной и разветвленной цепями, которые являются (относительно второстепенными) субстратом для глюконеогенеза.
Лактат транспортируется обратно в печень, где он превращается в пируват посредством Цикл Кори используя фермент лактатдегидрогеназа. Затем для выработки глюкозы можно использовать пируват, первый назначенный субстрат глюконеогенного пути.Трансаминирование или же дезаминирование аминокислот облегчает вступление их углеродного скелета в цикл напрямую (в виде пирувата или оксалоацетата) или косвенно через цикл лимонной кислоты. Вклад лактата цикла Кори в общее производство глюкозы увеличивается с увеличением голодание продолжительность. В частности, после 12, 20 и 40 часов голодания добровольцев-людей вклад лактата цикла Кори в глюконеогенез составил 41%, 71% и 92% соответственно.
Будь четно-цепь жирные кислоты может быть преобразован в глюкозу у животных — давний вопрос в биохимии.Жирные кислоты с нечетной цепью может быть окислен с получением ацетил-КоА и пропионил-КоА, последний служит предшественником сукцинил-КоА, который может превращаться в пируват и вступать в глюконеогенез. Напротив, жирные кислоты с четной цепью окисляются с образованием только ацетил-КоА, для вступления которого в глюконеогенез необходимо присутствие глиоксилатный цикл (также известный как глиоксилатный шунт) для производства четырехуглеродных предшественников дикарбоновой кислоты. Глиоксилатный шунт состоит из двух ферментов, малатсинтазы и изоцитратлиазы, и присутствует в грибах, растениях и бактериях. Несмотря на некоторые сообщения о ферментативной активности глиоксилатного шунта, обнаруженной в тканях животных, гены, кодирующие обе ферментативные функции, были обнаружены только у нематоды, в котором они существуют как один бифункциональный фермент. Гены, кодирующие только малатсинтазу (но не изоцитратлиазу), были идентифицированы в других многоклеточные животные включая членистоногие, иглокожие, и даже некоторые позвоночные. Млекопитающие, обладающие геном малатсинтазы, включают: монотремы (утконос) и сумчатые (опоссум), но нет плацентарные млекопитающие.
Существование глиоксилатного цикла у людей не было установлено, и широко распространено мнение, что жирные кислоты не могут быть напрямую преобразованы в глюкозу у людей. Углерод-14 было показано, что в конечном итоге в глюкозе поступает жирная кислота, но этого можно ожидать от включения меченых атомов, полученных из ацетил-КоА, в цикл лимонной кислоты промежуточные продукты, которые взаимозаменяемы с промежуточными продуктами, полученными из других физиологических источников, такими как глюкогенные аминокислоты. В отсутствие других глюкогенных источников 2-углеродный ацетил-КоА полученные в результате окисления жирных кислот, не могут производить чистый выход глюкозы через цикл лимонной кислоты, поскольку эквивалентные два атома углерода выделяются в виде диоксида углерода во время цикла. В течение кетозоднако ацетил-КоА из жирных кислот дает кетоновые тела, включая ацетон, и до ~ 60% ацетона может окисляться в печени до предшественников пирувата, ацетола и метилглиоксаль. Таким образом, кетоновые тела, полученные из жирных кислот, могут составлять до 11% глюконеогенеза во время голодания. Катаболизм жирных кислот также производит энергию в форме АТФ, которая необходима для пути глюконеогенеза.
Гликоген
Гликоген является одним из основных углеводов, типичным для человека и животных.
Определение
Гликоген – полисахарид, состоящий из большого количества (до n=30000) остатков глюкозы (рис. 1).
Эмпирическая формула гликогена – (С6Н10О5)n, где: С6Н10О5 – остаток глюкозы, n — количество остатков глюкозы.
Где содержится в организме человека
В организме человека содержится около 450 г гликогена. Треть этого количества (то есть около150 г) накапливается в печени, остальные две трети (около 300 г) накапливается в мышцах (Я. Кольман, К.-Г. Рём, 2004), рис. 2. Другими словами в печени содержится 5-6% от массы печени, в мышцах — 2-3% от массы мышц. Содержание гликогена в других органах незначительно. Гликоген печени служит прежде всего для поддержания уровня глюкозы в крови. Гликоген мышц служит резервом энергии и не участвует регуляции уровня глюкозы в крови.
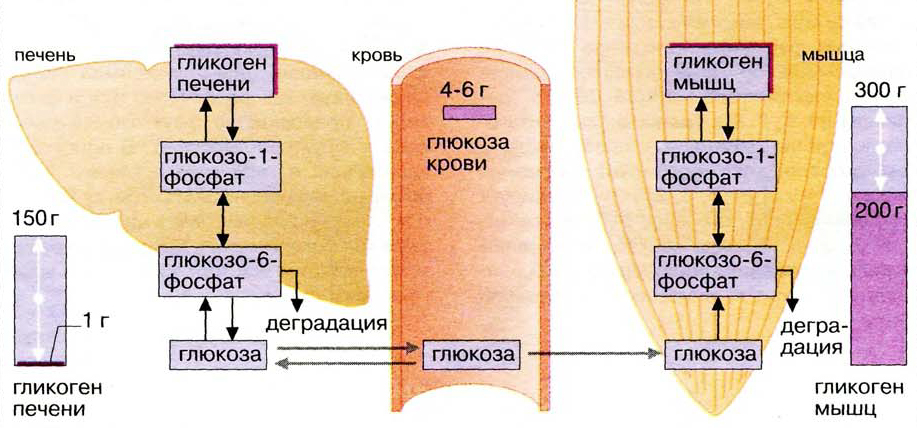
Рис. 2. Баланс гликогена в организме человека (Я. Кольман, К.-Г. Рём, 2004)
Синтез гликогена
Гликоген синтезируется в печени и мышцах из глюкозы, поступающей по кровеносным сосудам. Собственно, в печени гликоген представляет собой запасную, резервную форму глюкозы или депо глюкозы.
Свободная глюкоза не может накапливаться в печени и мышцах. Это связано с тем, что молекулы глюкозы имеют малые размеры и легко проходят через внешнюю оболочку клеток печени (гепатоцитов) и через сарколемму мышечных волокон (С.С. Михайлов, 2009). Синтез гликогена требует затрат энергии. Для присоединения к гликогену одного остатка глюкозы необходимо 41 кДж энергии. Синтез гликогена усиливает гормон инсулин.
О взаимосвязи гормонов и мышечной массы можно прочесть в моей книге «Гормоны и гипертрофия скелетных мышц человека»
Распад гликогена
В печени распад (лизис) гликогена называется гликогенолизом. Так как в гликоген печени распадается на глюкозу, этот процесс называется глюкогенезом. Он ускоряется гормонами глюкагоном, адреналином и норадреналином. При мышечной деятельности скорость мобилизации гликогена в печени зависит от интенсивности выполненной нагрузки. Так, например, при умеренной физической нагрузке скорость мобилизации гликогена возрастает в 2-3 раза, а при интенсивной – в 7-10 раз по сравнению с состоянием покоя.
Распад гликогена в печени происходит и во время отдыха. В результате этого образующаяся глюкоза способствует восстановлению запасов гликогена в сердечной мышце и скелетных мышцах (Н.И. Волков с соавт., 2000).
В мышцах гликоген обычно распадается при выполнении физической нагрузки. Распад гликогена стимулирует гормон адреналин. Если распад гликогена происходит в анаэробных условиях, этот процесс называется гликолизом.
Литература
- Кольман Я., Рём К.-Г. Наглядная биохимия.- М.: Мир, 2004.- 469 с.
- Мак-Комас, А. Дж. Скелетные мышцы. – Киев: Олимпийская литература, 2001.- 407 с.
- Михайлов, С. С. Спортивная биохимия. – М.: Советский спорт, 2009.– 348 с.
Влияние гликогена на вес тела
Как было сказано выше, общее количество запасов полисахарида составляет 400 г. Каждый грамм глюкозы связывает 4 грамма воды, значит, 400 г сложного углевода составляет 2 килограмма водного раствора гликогена. Во время тренировок организм тратит запасы энергии, теряя жидкость в 4 раза больше – это объясняется потоотделение.
Сюда же отнесится результативность экспресс-диет для похудения: безуглеводный рацион питания приводит к интенсивному расходу гликогена, а заодно жидкости. 1 л воды = 1 кг веса. Но вернувшись к рациону с привычным содержанием калорий и углеводов, запасы восстанавливаются вместе с потерянной на диете жидкостью. Это объясняет кратковременность эффекта быстрой потери веса.

Похудеть без негативных последствий для здоровья и возвращения потерянных килограммов поможет правильный подсчет суточной потребности в калориях и физические нагрузки, способствующие расходу гликогена.
Дефицит и излишек — как определить?
Избыток гликогена сопровождается сгущением крови, сбоем работы печени и кишечника, набором лишнего веса.
Дефицит полисахарида приводят к расстройствам психоэмоционального состояния – развивается депрессия, апатия. Снижается концентрация внимания, иммунитет, наблюдается потеря мышечной массы.

Недостаток энергии в организме снижает жизненный тонус, сказывается на качестве и красоте кожи и волос. Пропадает мотивация тренироваться и в принципе выходить из дома. Как только вы заметили подобные симптомы, необходимо позаботиться о восполнении гликогена в организме с помощью читмила или корректировки плана питания.
Какое количество гликогена находится в мышцах
Из 400 г гликогена 280-300 г запасается в мышцах и расходуется во время тренировок. Под воздействием физической нагрузки усталость возникает из-за истощения запасов. В связи с этим за полтора-два часа до начала тренинга рекомендуется употребить продукты с большим содержанием углеводов с целью пополнения резервов.
Гликогеновое депо человека изначально минимальное и обусловлено только двигательными потребностями. Запасы увеличиваются уже спустя 3-4 месяца систематических интенсивных тренировок с высоким объемом нагрузки благодаря насыщению мышц кровью и принципу суперкомпенсации. Это приводит к:
- увеличению выносливости;
- росту мышечной массы;
- изменению веса в процессе тренировки.
Специфика гликогена заключается в невозможности влияния на силовые показатели, а для увеличения гликогенового депо необходимы многоповторные тренировки. Если рассматривать с точки зрения паурлифтинга, то представители этого вида спорта не обладают серьезными запасами полисахарида ввиду специфики тренировок.
Когда вы ощущаете бодрость на тренировках, хорошее настроение, а мышцы выглядят наполненными и объемными – это верные признаки достаточного запаса энергии из углеводов в мышечных тканях.
Зависимость жиросжигания от гликогена
Час силовой или кардио нагрузки требует 100-150 г гликогена. Как только запасы заканчиваются, начинается разрушение мышечного волокна, а затем жировой ткани, чтобы организм получил энергию.
Для избавления от лишних килограммов и жировых отложений в проблемных местах во время сушки оптимальным временем тренинга будет длительный интервал между последним приемом пищи – натощак с утра, когда запасы гликогена истощены. Для сохранения мышечной массы во время «голодной» тренировки рекомендуется употребить порцию BCAA.
Как гликоген влияет на наращивание мышечной массы
Положительный результат в увеличении количества мышечной массы тесно связан с достаточным объемом гликогена на физические нагрузки и на восстановление запасов после. Это обязательное условие и в случае пренебрежения можно забыть о достижении поставленной цели.

Тем не менее, не следует устраивать углеводную загрузку незадолго до похода в тренажерный зал. Интервалы между едой и силовыми тренировками следует постепенно увеличивать – это учит организм разумно распоряжаться запасами энергии. На этом принципе построена система интервального голодания, которая позволяет набирать качественную массу без лишнего жира.
Клиническая значимость
Нарушения метаболизма гликогена
Наиболее распространенным заболеванием, при котором метаболизм гликогена становится ненормальным, является диабет, при котором из-за аномальных количеств инсулина гликоген печени может аномально накапливаться или истощаться. Восстановление нормального метаболизма глюкозы обычно нормализует метаболизм гликогена. При гипогликемии, вызванной чрезмерным уровнем инсулина, количества гликогена в печени высоки, но высокие уровни инсулина предотвращают гликогенолиз, необходимый для поддержания нормального уровня сахара в крови. Глюкагон является распространенным методом лечения этого типа гипогликемии. Различные врожденные ошибки метаболизма вызваны недостатками ферментов, необходимых для синтеза или расщепления гликогена. Они также называются заболеваниями, связанными с хранением гликогена.
Эффект истощения гликогена и выносливость
Спортсмены, бегающие на длинные дистанции, такие как марафонские бегуны, лыжники и велосипедисты, часто испытывают истощение гликогена, когда почти все запасы гликогена в организме спортсмена истощаются после длительных нагрузок без достаточного потребления углеводов. Истощение гликогена может быть предотвращено тремя возможными способами. Во-первых, во время упражнения углеводы с максимально возможной скоростью преобразования в глюкозу крови (высокий гликемический индекс) поступают непрерывно. Наилучший результат этой стратегии заменяет около 35% глюкозы, потребляемой при сердечных ритмах, выше примерно 80% от максимума. Во-вторых, благодаря адаптационным тренировкам на выносливость и специализированным схемам (например, тренировки с низкой степенью выносливости плюс диета), организм может определять мышечные волокна типа I для улучшения эффективности использования топлива и рабочей нагрузки для увеличения процента жирных кислот, используемых в качестве топлива, чтобы сберечь углеводы. В-третьих, при потреблении больших количеств углеводов после истощения запасов гликогена в результате физических упражнений или диеты, организм может увеличить емкость хранилищ внутримышечных гликогенов. Этот процесс известен как «углеводная нагрузка». В общем, гликемический индекс источника углеводов не имеет значения, поскольку чувствительность мышечного инсулина в результате временного истощения гликогена увеличивается. При недостатке гликогена, спортсмены часто испытывают сильную усталость, до такой степени, что им может быть трудно просто ходить. Что интересно, самые лучшие профессиональные велосипедисты в мире, как правило, заканчивают 4-5-ступенчатую гонку прямо на пределе истощения гликогена с использованием первых трех стратегий. Когда спортсмены употребляют углевод и кофеин после истощающих упражнений, их запасы гликогена, как правило, пополняются быстрее , однако минимальная доза кофеина, при которой наблюдается клинически значимое влияние на насыщение гликогена, не установлена.
Список использованной литературы:
Kreitzman SN, Coxon AY, Szaz KF (1992). «Glycogen storage: illusions of easy weight loss, excessive weight regain, and distortions in estimates of body composition» (PDF). The American Journal of Clinical Nutrition. 56 (1 Suppl): 292s–293s. PMID 1615908
Miwa I, Suzuki S (November 2002). «An improved quantitative assay of glycogen in erythrocytes». Annals of Clinical Biochemistry. 39 (Pt 6): 612–3. PMID 12564847. doi:10.1258/000456302760413432
Berg, Tymoczko & Stryer (2012). Biochemistry (7th, International ed.). W. H. Freeman. p. 338. ISBN 1429203145.
F. G. Young (1957). «Claude Bernard and the Discovery of Glycogen». British Medical Journal. 1 (5033 (Jun. 22, 1957)): 1431–7. JSTOR 25382898. doi:10.1136/bmj.1.5033.1431
Stryer, L. (1988) Biochemistry, 3rd ed., Freeman (p. 451)
McDonald, Lyle. The Ultimate Diet 2.0. Lyle McDonald, 2003
Beelen M, Burke LM, Gibala MJ, van Loon L JC (December 2010). «Nutritional strategies to promote postexercise recovery». International Journal of Sport Nutrition and Exercise Metabolism. 20 (6): 515–532. PMID 21116024. doi:10.1123/ijsnem.20.6.515
Регулирование
Хотя большинство шагов в глюконеогенезе обратны тем, что обнаружены в гликолиз, три регулируемых и сильно эндергонических реакции заменяются более кинетически благоприятными реакциями. Гексокиназа/глюкокиназа, фосфофруктокиназа, и пируваткиназа ферменты гликолиза заменены на глюкозо-6-фосфатаза, фруктозо-1,6-бисфосфатаза, и Карбоксикиназа ПЭП/ пируваткарбоксилаза. Эти ферменты обычно регулируются подобными молекулами, но с противоположными результатами. Например, ацетил-КоА и цитрат активируют ферменты глюконеогенеза (пируваткарбоксилазу и фруктозо-1,6-бисфосфатаза соответственно), в то же время ингибируя гликолитический фермент пируваткиназа. Эта система взаимного контроля позволяет гликолизу и глюконеогенезу подавлять друг друга и предотвращает бесполезный цикл синтезировать глюкозу, чтобы только расщепить ее.
Большинство ферменты ответственные за глюконеогенез находятся в цитозоль; исключение составляют митохондриальные пируваткарбоксилаза а у животных фосфоенолпируваткарбоксикиназа. Последний существует как изофермент, расположенный как в митохондрия и цитозоль. Скорость глюконеогенеза в конечном итоге контролируется действием ключевого фермента, фруктозо-1,6-бисфосфатаза, который также регулируется посредством передачи сигнала лагерь и его фосфорилирование.
Глобальный контроль глюконеогенеза опосредуется глюкагон (высвобождается при низком уровне глюкозы в крови); запускает фосфорилирование ферментов и регуляторных белков путем Протеинкиназа А (киназа, регулируемая циклическим АМФ), что приводит к ингибированию гликолиза и стимуляции глюконеогенеза. Инсулин противодействует глюкагону, подавляя глюконеогенез. Диабет 2 типа характеризуется избытком глюкагона и резистентность к инсулину от тела. Инсулин больше не может подавлять экспрессию генов ферментов, таких как PEPCK, что приводит к повышению уровня гипергликемии в организме. Антидиабетический препарат метформин снижает уровень глюкозы в крови, прежде всего, за счет ингибирования глюконеогенеза, преодолевая неспособность инсулина ингибировать глюконеогенез из-за инсулинорезистентности.
Исследования показали, что отсутствие продукции глюкозы в печени не оказывает существенного влияния на контроль концентрации глюкозы в плазме натощак. Компенсаторная индукция глюконеогенеза происходит в почках и кишечнике за счет глюкагон, глюкокортикоидыи ацидоз.
Резистентность к инсулину
В печени FOX белок FoxO6 обычно способствует глюконеогенезу натощак, но инсулин блокирует Fox06 при кормлении. В состоянии резистентность к инсулину инсулин не может блокировать FoxO6, что приводит к продолжению глюконеогенеза даже при кормлении, что приводит к высокому уровню глюкозы в крови (гипергликемия).
Инсулинорезистентность — общая черта метаболический синдром и диабет 2 типа. По этой причине глюконеогенез является целью терапии диабета 2 типа, такого как противодиабетический препарат метформин, который подавляет образование глюконеогенной глюкозы и стимулирует поглощение глюкозы клетками.
Метаболизм [ править ]
Синтез править
Синтез гликогена, в отличие от его расщепления, является эндергоническим — он требует затрат энергии. Энергия для синтеза гликогена поступает от уридинтрифосфата (UTP), который реагирует с глюкозо-1-фосфатом , образуя UDP-глюкозу , в реакции, катализируемой UTP — глюкозо-1-фосфатуридилтрансферазой . Гликоген синтезируется из мономеров UDP-глюкозы первоначально белком гликогенином , который имеет два тирозиновых якоря для восстанавливающего конца гликогена, поскольку гликогенин является гомодимером. После добавления примерно восьми молекул глюкозы к остатку тирозина фермент гликогенсинтазапрогрессивно удлиняет цепь гликогена, используя UDP-глюкозу, добавляя α (1 → 4) -связанную глюкозу к восстанавливающему концу цепи гликогена.
Гликоген ветвления фермента катализирует перенос концевого фрагмента шесть или семь остатков глюкозы из невосстанавливающего конца к С-6 гидроксильной группы остатка глюкозы глубже внутрь молекулы гликогена. Фермент разветвления может действовать только на ответвление, имеющее по крайней мере 11 остатков, и фермент может переноситься на ту же самую цепь глюкозы или соседние цепи глюкозы.
Разбивка править
Гликоген отщепляется от невосстанавливающих концов цепи ферментом гликогенфосфорилазой с образованием мономеров глюкозо-1 фосфата:
В естественных условиях, фосфорилаза протекает в направлении распада гликогена , поскольку отношение фосфата и глюкозо-1-фосфата, как правило , больше , чем 100. Глюкоза-1 фосфат затем преобразуется в глюкозо-6-фосфат (G6P) по фосфоглюкомутазам . Для удаления α (1-6) разветвлений разветвленного гликогена и преобразования цепи в линейный полимер необходим специальный разветвляющий фермент . Произведенные мономеры G6P имеют три возможных судьбы:
- G6P может продолжать путь гликолиза и использоваться в качестве топлива.
- G6P может вступать в пентозофосфатный путь через фермент глюкозо-6-фосфатдегидрогеназу с образованием НАДФН и 5 углеродных сахаров.
- В печени и почках G6P может обратно дефосфорилироваться до глюкозы с помощью фермента глюкозо-6-фосфатазы . Это последний этап пути глюконеогенеза .
Биохимические свойства
Полисахарид с формулой (C6H10O5)n химики называют гликогеном. Другое название этого вещества – животный крахмал. И хоть гликоген хранится в животных клетках, но это название является не совсем правильным. Открыл вещество французский физиолог Бернар. Почти 160 лет тому назад ученый впервые нашел в клетках печени «запасные» углеводы.
«Запасной» углевод хранится в цитоплазме клеток. Но если организм ощущает внезапный недостаток глюкозы, гликоген высвобождается и попадает в кровь. Но, что интересно, трансформироваться в глюкозу, которая способна насытить «голодный» организм, способен только полисахарид, накопленный в клетках печени (гепатоцитах). Запасы гликогена в ней могут достигать 5 % от ее массы, и во взрослом организме составлять около 100-120 г. Своей максимальной концентрации гликоген в гепатоцитах достигает примерно через полтора часа после трапезы, насыщенной углеводами (кондитерские изделия, мучное, крахмалистая пища).
В составе мышц полисахарид занимает не больше 1-2 % от массы ткани. Но, учитывая общую массу мускул, становится понятно, что гликогеновые «залежи» в мышцах превышают запасы вещества в печени. Также небольшие запасы углевода есть в почках, глиальных клетках мозга и в лейкоцитах (белых кровяных клетках). Таким образом, общие запасы гликогена во взрослом организме могут составить почти полкилограмма.
Интересно, что «запасной» полисахарид найден в клетках некоторых растений, в грибах (дрожжевых) и бактериях.