Гликолиз и его субстраты
Содержание:
- Обходной путь 3. Образование глюкозы
- 2.3- БФГ в норме и при патологииПравить
- Распространение и значение
- Что такое гликолиз
- Обходной путь 1. Образование фосфоенолпирувата
- История исследования
- Бескислородное окисление глюкозы включает два этапа
- Значение гликолиза
- Глюконеогенез
- Гликолиз – ход реакции
- ЛокализацияПравить
- Путь[править]
- Значение гликолиза в физиологии живых организмов
Обходной путь 3. Образование глюкозы
От глюкозо-6-фосфата отщепляется фосфатная группа. Катализирует реакцию глюкозо-6-фосфатаза.
Образование глюкозы в третьем обходном пути
Но этот фермент не может находиться в цитоплазме. Почему? Тогда клетка не смогла бы выполнять свои функции. Представьте, что глюкоза попадает в печень. Она сразу же фосфорилируется с помощью глюкокиназы. Так клетка добивается двух вещей:
- Увеличивает реакционную способность глюкозы;
- Не даёт глюкозе выбраться из клетки. Потому что для глюкозо-6-фосфата нет белков переносчиков в цитоплазме. А вот для обычной глюкозы есть —
Если мы засунем в эту систему фермент глюкозо-6-фосфатазу, то она будет постоянно превращать глюкозо-6-фосфат в глюкозу. А та будет вылетать из клетки. Получается, что вся система работает в холостую. Поэтому глюкозо-6-фосфатаза не работает в цитоплазме, а находится в эндоплазматическом ретикулуме (ЭПР). Он отделён от цитоплазмы биологической мембраной.
В мембране ЭПР есть белки переносчики для глюкозо-6-фосфата. Он переносится в ЭПР, где дефосфорилируется глюкозо-6-фосфатазой. Образуется глюкоза и неорганический фосфат. Они переносятся в цитоплазму, опять же с помощью своих белков переносчиков. А дальше глюкоза попадает в кровь через глюкозный транспортёр второго типа.
Глюкозо-6-фосфатаза работает в эндоплазматическом ретикулуме. Так клетка избегает холостых реакций.
Вот и весь глюконеогенез. Держите общую картинку.
Пируваткарбоксилаза не влезла, извиняйте.
2.3- БФГ в норме и при патологииПравить
Эмбриональный гемоглобин имеет низкое сродство к 2,3-БФГПравить
Гемоглобин — тетрамер. состоящий из двух альфа-цепей и двух бета-цепей. Фетальный гемоглобин имеет иное строение: он состоит из двух а-цепей и двух у-цепей. По сравнению с нормальным гемоглобином взрослого человека, фетальный гемоглобин имеет более низкое сродство к 2,3-БФГ. Это значит, что сродство к кислороду у фетального гемоглобина выше, чем у гемоглобина материнского организма. Благодаря этому происходит транспорт кислорода от материнского организма к азолу.
2.3- БФГ и высотная адаптацияПравить
Предположим, что некий житель низин решил провести отпуск в горах. В первые дни отпуска даже незначительные физические нагрузки вызовут у него усталость и одышку. Но за несколько дней произойдет адаптация к высокогорью — в эритроцитах повысится концентрация 2,3-БФГ. Благодаря этому ткани станут получать кислород в достаточном количестве. несмотря на то что его концентрация в разреженном горном воздухе невысока.Повышение концентрации 2,3-БФГ — ответная реакция организма на недостаток кислорода
У курящих лиц концентрация 2,3-БФГ в эритроцитах выше, чем у некурящих. Так организм компенсирует сниженное вследствие постоянного воздействия угарного газа обеспечение тканей кислородом. Компенсаторное повышение уровня 2.3- БФГ также часто наблюдается у больных хроническими анемиями, обструктивной болезнью легких, при врожденных пороках сердца и муковисцидозе.
Энзимопатии гликолитического пути в эритроцитахПравить
В редких случаях из-за врожденной недостаточности гликолитических ферментов в эритроцитах развивается наследственная несфероцитарная гемолитическая анемия. Это заболевание может быть весьма тяжелым, поскольку в эритроцитах гликолиз — единственный путь синтеза и АТФ и 2.3-БФГ.
Нарушения гликолитического ферментативного аппарата могут по-разному сказываться на метаболизме 2.3-БФГ (рис. 18.2). Если нарушение расположено проксимально по отношению к 2.3-БФГ-шунту (например, при недостаточности гексокиназы, фосфоглюкоизомеразы или альдолазы А), уровень 2,3-БФГ будет снижен, так как будет снижена интенсивность синтеза его предшественников. Если же нарушение расположено после 2.3-БФГ-шунта (например, недостаточность пируваткиназы). концентрация 2.3-БФГ в эритроцитах будет повышена.
Кроме того, у ряда больных была обнаружена недостаточность бифункционального фермента шунта — БФГ-мутазы/2,3-БФГ-фосфагазы. У таких больных концентрация 2.3- БФГ была низкой.
Номенклатура альдолазПравить
Чтобы учащийся не путал разные термины, необходимо разобраться в номенклатуре альдолаз. Альдолаза (полное название — фруктозо-1,6-бисфосфат-атьдолаза) по официальной номенклатуре называется D-глицеральдегид-З-фосфатлиазой (КФ 4.1.2.13). Она выполняет три функции:
катализирует реакцию конденсации дигидрокснацетон-фосфата и глицеральдегид-З-фосфата. Продукт этой реакции — фруктозо-1,6-бисфосфат;
катализирует расщепление фруктозо-1,6-бисфосфата на лигилроксиацетонфосфат и минеральдегид-3-фосфат;
катализирует расщепление других, структурно близких фосфатов сахаров. Так. альдолаза катализирует расщепление фруктозо-1-фосфата на дигидроксиацетонфосфат и глицеральдегид (примечание: раньше фермент, выполняющий эту функцию, называли кетозо-1-фосфат-альдолазой. КФ 4.1.2.7).
У животных обнаружены три формы альдолазы.
Альдолаза А. Содержится в эритроцитах и мышцах. При наследственной гемолитической анемии в крови содержится дефектная форма альдолазы А.
Альдолаза В. Недостаточность альдолазы В приводит к наследственной непереносимости фруктозы. Альдолаза В присутствует в печени, почках и тонком кишечнике.
Альдолаза С. Содержится в головном мозге.
Распространение и значение
Гликолиз является почти универсальным для всех клеточных организмов путем катаболизма глюкозы. Вероятно, он возник на ранних этапах развития жизни на Земле, еще до того, как в атмосфере накопился кислород в результате деятельности фотосинтезирующих организмов. Последовательность гликолитических реакций — чрезвычайно эволюционно консервативный путь. Ферменты, которые принимают в нем участие, проявляют высокую степень гомологии как в аминокислотной последовательности, так и трехмерной структуре у позвоночных животных, дрожжей и растений. Как показало секвенирования ДНК геномов большого количества организмов, только в некоторых архей и паразитических бактерий отсутствуют один или несколько ферментов гликолиза, несмотря на то, что сам путь сохраняется, вероятно, в модифицированном виде.
В эукариотических клетках реакции гликолиза происходят в цитозоле. В большинстве таких клеток именно этот среди других метаболических путей занимает первое место по количеству атомов углерода, которые превращаются в нем. Для таких тканей млекопитающих, как мозг (за исключением условий голодания), мозговой слой почек, сперматозоиды, а также эритроциты, в которых полностью отсутствуют митохонондрии, гликолиз является единственным источником метаболической энергии. Для мышц в условиях очень большой нагрузки гликолиз выгоден не только потому, что дает возможность получить энергию при недостатке кислорода, а еще и потому, что он происходит очень быстро и обеспечивает синтез АТФ в 10,5 раз быстрее, чем аэробная окисления органических веществ . Также от гликолиза главным образом зависят растительные ткани, специализированные на хранении крахмала (например клубни картофеля), и водные растения, такие как настурция лекарственная.
Другими путями окисления глюкозы является пентозофосфатный путь и путь Энтнера-Дудорова. Последний является заменой гликолиза в некоторых грамотрицательных и, очень редко, грамположительных бактерий и имеет много общих черт с ним ферментов.
Что такое гликолиз
В общих чертах, гликолиз — это процесс, который происходит в цитоплазме всех клеток: от низших бактерий до высших млекопитающих — людей. Для некоторых это единственный метаболический путь доставки энергии клетке — например, для бактерий, для других же это метаболический путь, в который «сливаются» и другие метаболиты — белки и липиды.
Гликолиз — это основной путь расщепления глюкозы в нашем организме, основное биологическое значениеэтого процесса заключается в получении энергии и других продуктов обмена.
 Гликолиз происходит как в аэробных, так и в анаэробных условиях. Процесс в анаэробных условиях (недостаток кислорода) называется анаэробным гликолизом — конечным продуктом лактата и ферментации в дрожжах — алкогольной или молочнокислой ферментации.
Гликолиз происходит как в аэробных, так и в анаэробных условиях. Процесс в анаэробных условиях (недостаток кислорода) называется анаэробным гликолизом — конечным продуктом лактата и ферментации в дрожжах — алкогольной или молочнокислой ферментации.
При наличии кислорода этот процесс называется аэробным гликолизом — конечным продуктом выступают CO2 и H2O,
Гликолиз представляет собой серию реакций, в которых одна молекула глюкозы распадается на две молекулы пирувата. Но так происходит не всегда, в случаях когда доступ кислорода в этой реакции затруднен, проще говоря, в анаэробных условиях, то пируват превращается в лактат или спирт.
Механизмы анаэробного метаболизма: гликолиз в анаэробных условиях
В анаэробных условиях O2 отсутствует. Отсутствие конечного субстрата O2 ингибирует активность дыхательных структур (до этого они неактивны), и таким образом конечным продуктом распада глюкозы в анаэробных условиях является лактат,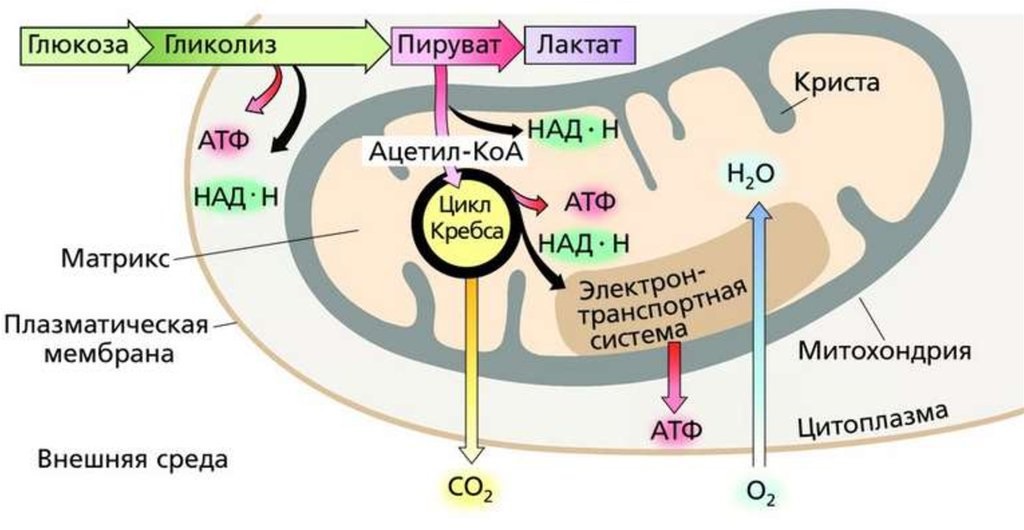
Анаэробный распад глюкозы в физиологических условиях наблюдается в эритроцитах (без митохондрий) и в сильно сокращающихся мышцах (недостаточное кровоснабжение кислородом), это наблюдается при сильной физической работе — присутствует истощение O2 в мышечных клетках (в форме оксимиоглобина).
Лактат в мышечных клетках приводит к мышечной лихорадке, которая преодолевается неинтенсивной мышечной активностью, направленной на полное расщепление лактата в мышцах, до CO2 , H2O и H2 в результате аэробного гликолиза.
При патологических состояниях и онкологических заболеваниях, у многих людей наблюдается так называемый эффект Пастера, при котором клетки из-за уменьшенного поступления крови или кислорода переключаются на анаэробный распад глюкозы, связанный с повышенным ее потреблением (повышенная экспрессия трансмиттеров глюкозы GLUT1 ) и гипогликемией.
Анаэробный гликолиз, как при физиологических, так и при патологических состояниях, характеризуется повышенным уровнем конечного продукта в результате расщепления его лактата в плазме крови — лактатемией, что может привести к ацидозу.
Дальнейшее расщепление лактата
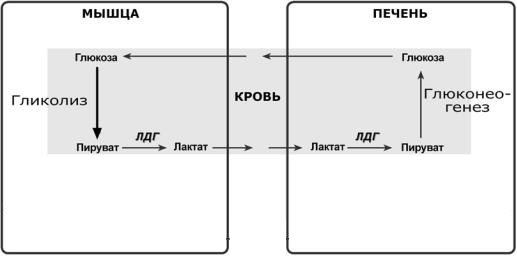
Лактат метаболизируется из печени в пируват, катализируя реакцию в обратном направлении, и глюкоза синтезируется пируватом с использованием ферментов глюконеогенеза в печени через цикл Кори (лактатный цикл).
Вот в этой схеме и кроется ответ на вопрос о том, как влияет анаэробный гликолиз на производство энергии, ведь мы видим, что наша молочная кислота, образовавшаяся в мышцах, через кровь попадает в печень и участвует в процессе глюконеогенеза — создания глюкозы из неуглеводных продуктов.
Обходной путь 1. Образование фосфоенолпирувата
Пируват, который образовался в ходе гликолиза был транспортирован в митохондрию. Нам повезло, потому что первый фермент обходного пути тоже находится в матриксе митохондрии. Этот фермент — митохондриальная пируваткарбокилаза.
Пируваткарбоксилаза присоединяет к пирувату CO2 — образуется оксалоацетат.
Первая реакция в образовании фосфоенолпирувата. Идёт в матриксе митохондрий.
Для этой реакции нужны молекула АТФ и кофермент — биотин. АТФ тратится на активацию бикарбонатного иона, так как у нас в организме большая часть CO2 растворена. Из бикарбонатного иона образуется CO2, который присоединяется к биотину. Биотин переносит CO2 на молекулу пирувата, клетка получает оксалоацетат.
Дальше нужно перенести оксалоацетат в цитоплазму клетки — там находятся семь ферментов, которые катализируют обратимые реакции гликолиза. Для оксалоацетата во внутренней мембране митохондрий нет переносчика. Но есть для малата. Поэтому сначала оксалоацетат превращается в малат. Катализатор — митохондриальная малатдегидрогеназа. Она присоединяет два протона и два электрона к молекуле оксалоацетата. Кофермент реакции — НАДH. Так образуется малат.
Образование малата в митохондрии
Митохондриальная малатдегидрогеназа обычно катализирует обратную реакцию — превращение малата в оксалоацетат. Так было в но почему здесь всё по-другому? Дело в том, что в митохондрии находится избыток НАДH, а не НАД+. Поэтому реакция идёт в другую сторону. Избыток НАДH обеспечивает окисление жирных кислот — запускается при голодании и/или физической нагрузке.
Далее малат транспортируется через внутреннюю мембрану с помощью белка-переносчика. В наружной мембране есть поры, поэтому дальше он влетает в цитоплазму.
Транспорт малата в цитоплазму
В цитоплазме клетки малат превращается в оксалоацетат с помощью цитоплазматической малатдегидрогеназы. При этом образуется оксалоацетат и НАДH. Эта реакция полезна, так как в шестой реакции для образования глицеральдегид-3-фосфата нужен НАДH. Так митохондрия передаёт избыток протонов и электронов на нужды цитоплазмы — всё это через образование малата.
Образование оксалоацетата в цитоплазме клетки
Теперь нужно превратить оксалоацетат в фосфоенолпируват. Для этого нужен второй фермент этого обходного пути — фосфоенолпируваткарбоксикиназа. Он получил название по обратной реакции. Кроме фермента, нужен источник энергии и фосфатной группы — здесь используется ГТФ. Образуется фосфоенолпируват, ГДФ и CO2. Так клетка обходит десятую реакцию гликолиза.
Вторая реакция обходного пути. Образование фосфоенолпирувата с помощью декарбоксилирования оксалоацетата
Пока что глюконеогенез дорогой процесс. Мы затратили молекулу АТФ и ГТФ на образование фосфоенолпирувата. А эта молекула содержит только три атома углерода. Для образования глюкозы нужно образовать два фосфоенолпирувата. То есть общие затраты энергии — 2 молекулы АТФ и 2 ГТФ.
Дальше идут обратимые реакции до образования фруктозо-1,6-бисфосфата (третья реакция гликолиза). В ходе седьмой реакции мы затратим ещё две молекулы АТФ на образование двух 1,3-бисфосфоглицератов.
Общие затраты энергии — 4 молекулы АТФ и 2 молекулы ГТФ. Дальше клетка не будет тратиться на синтез глюкозы, так что это общие затраты на весь глюконеогенез.
Хоть этот процесс и дорогой, но других вариантов у организма нет. Нельзя же бросить мозг и эритроциты — без них тело долго не проживёт.
История исследования
Гликолиз первый из открытых и наиболее исследован метаболический путь. 1897 братья Ганс и Эдуард Бюхнер занимались изготовлением бесклеточной экстрактов дрожжей для терапевтического применения. Очевидно, они не могли использовать ядовитые для человека антисептики, как фенол, поэтому попытались распространен в кулинарии консервант — сахарозу. Выяснилось, что в дрожжевых экстрактах это вещество быстро зброджувалась к этиловому спирту. Так впервые установлено, что брожение может происходить вне живых клеток. В 1907 году Эдуарду Бюхнеру была присуждена Нобелевская премия по химии.
Со времени открытия внеклеточного брожения до 1940-х годов исследования реакций гликолиза было одной из основных задач биохимии. Описанием этого метаболического пути в клетках дрожжей занимались Отто Варбург, Ганс фон Эйлер-Хельпин и Артур Гарден (два последних получили Нобелевскую премию по химии 1929 года), в мышцах — Густав Эмбден и Отто Меергоф (Нобелевская премия по медицине и физиологии 1922 ). Также свой вклад в исследование гликолиза сделали Карл Нойберг, Яков Парнас, Герти и Карл Кори.
Важными «побочными» открытиями, сделанными благодаря изучению гликолиза, была разработка многих методов очистки ферментов, выяснения центральной роли АТФ и других фосфорильованих соединений в метаболизме, открытие коэнзимов, таких как НАД.
Бескислородное окисление глюкозы включает два этапа
В анаэробном процессе пировиноградная кислота восстанавливается до молочной кислоты (лактата), поэтому в микробиологии анаэробный гликолиз называют молочнокислым брожением. Лактат является метаболическим тупиком и далее ни во что не превращается, единственная возможность утилизовать лактат – это окислить его обратно в пируват.
Многие клетки организма способны к анаэробному окислению глюкозы. Для эритроцитов он является единственным источником энергии.
Клетки скелетной мускулатуры за счет бескислородного расщепления глюкозы способны выполнять мощную, быструю, интенсивную работу, как, например, бег на короткие дистанции, напряжение в силовых видах спорта.
Вне физических нагрузок бескислородное окисление глюкозы в клетках усиливается при гипоксии – при различного рода анемиях, при нарушении кровообращения в тканях независимо от причины.
Первый этап гликолиза – подготовительный, здесь происходит затрата энергии АТФ, активация глюкозы и образование из нее триозофосфатов.
Первая реакция гликолиза сводится к превращению глюкозы в реакционно-способное соединение за счет фосфорилирования 6-го, не включенного в кольцо, атома углерода. Эта реакция является первой в любом превращении глюкозы, катализируется гексокиназой.
Вторая реакция необходима для выведения еще одного атома углерода из кольца для его последующего фосфорилирования (фермент глюкозофосфат-изомераза). В результате образуется фруктозо-6-фосфат.
Третья реакция – фермент фосфофруктокиназа фосфорилирует фруктозо-6-фосфат с образованием почти симметричной молекулы фруктозо-1,6-дифосфата. Эта реакция является главной в регуляции скорости гликолиза.
В четвертой реакции фруктозо-1,6-дифосфат разрезается пополам фруктозо-1,6-дифосфат-альдолазой с образованием двух фосфорилированных триоз-изомеров – альдозы глицеральдегида (ГАФ) и кетозы диоксиацетона (ДАФ).
Пятая реакция подготовительного этапа – переход глицеральдегидфосфата и диоксиацетонфосфата друг в друга при участии триозофосфатизомеразы. Равновесие реакции сдвинуто в пользу диоксиацетонфосфата, его доля составляет 97%, доля глицеральдегидфосфата – 3%. Эта реакция, при всей ее простоте, определяет дальнейшую судьбу глюкозы:
- при нехватке энергии в клетке и активации окисления глюкозы диоксиацетонфосфат превращается в глицеральдегидфосфат, который далее окисляется на втором этапе гликолиза,
- при достаточном количестве АТФ, наоборот, глицеральдегидфосфат изомеризуется в диоксиацетонфосфат, и последний отправляется на синтез жиров.
Второй этап гликолиза – это освобождение энергии, содержащейся в глицеральдегидфосфате, и запасание ее в форме АТФ.
Шестая реакция гликолиза (фермент глицеральдегидфосфат-дегидрогеназа) – окисление глицеральдегидфосфата и присоединение к нему фосфорной кислоты приводит к образованию макроэргического соединения 1,3-дифосфоглицериновой кислоты и НАДН.
В седьмой реакции (фермент фосфоглицераткиназа) энергия фосфоэфирной связи, заключенная в 1,3-дифосфоглицерате тратится на образование АТФ.
Реакция получила дополнительное название – реакция субстратного фосфорилирования, что уточняет источник энергии для получения макроэргической связи в АТФ (от субстрата реакции) в отличие от окислительного фосфорилирования (от электрохимического градиента ионов водорода на мембране митохондрий).
Восьмая реакция – синтезированный в предыдущей реакции 3-фосфоглицерат под влиянием фосфоглицератмутазы изомеризуется в 2-фосфоглицерат.
Девятая реакция – фермент енолаза отрывает молекулу воды от 2-фосфоглицериновой кислоты и приводит к образованию макроэргической фосфоэфирной связи в составе фосфоенолпирувата.
Десятая реакция гликолиза – еще одна реакция субстратного фосфорилирования – заключается в переносе пируваткиназой макроэргического фосфата с фосфоенолпирувата на АДФ и образовании пировиноградной кислоты.
Последняя реакция бескислородного окисления глюкозы, одиннадцатая – образование молочной кислоты из пирувата под действием лактатдегидрогеназы
Важно то, что эта реакция осуществляется только в анаэробных условиях. Эта реакция необходима клетке, так как НАДН, образующийся в 6-й реакции, в отсутствие кислорода не может окисляться в митохондриях
| У плода и детей первых месяцев жизни преобладает анаэробный распад глюкозы, в связи с чем концентрация молочной кислоты в крови у них выше чем у взрослых. |
| При наличии кислорода пировиноградная кислота переходит в митохондрию и превращается в ацетил-S-КоА. |
Значение гликолиза
Гликолиз — это уникальный, однако не единственный вид окисления глюкозы в организме, клетке как прокариотов, так и эукариотов. Ферменты гликолиза являются водорастворимыми. Реакция гликолиза в некоторых тканях и клетках может происходить только таким образом, например, в мозгу и клетках нефронов печени. Другие способы окисления глюкозы в этих органах не используются. Однако не везде функции гликолиза одинаковы. Например, жировые ткани и печени в процессе пищеварения добывают необходимые субстраты из глюкозы для синтеза жиров. Многие растения используют гликолиз как способ добычи основной части энергии.
Глюконеогенез
Я боюсь запутать тебя, если скажу, что глюконеогенез — это обратный гликолизу процесс. Но этого хватит для того, чтобы понять его суть. В ходе разбора мы поймём, что это не так (или не совсем так). При гликолизе мы разрушали глюкозу до пирувата или лактата. В зависимости от типа гликолиза: аэробного или анаэробного. Почему бы не повернуть гликолиз обратно? Так из двух молекул пирувата можно будет получить глюкозу.
Клетка примерно так и делает, но с одним большим НО. Гликолиз — это необратимый процесс. Если мы посмотрим на него, то увидим такое…
Общая схема гликолиза. Первая, третья и десятая реакции необратимы!
Первая, третья и десятая реакция не могут идти в обратную сторону. Поэтому весь гликолиз — необратимый процесс. Но почему эти реакции необратимы?
В ходе первой синтезируется глюкозо-6-фосфат, а в ходе третьей — фруктозо-1,6-бисфосфат. У этих реакций есть кое-что общее. В них гидролизуется макроэргическая связь ( отмечена «~») в молекуле АТФ. Что приводит к высвобождению большого количества энергии — эти реакции экзотермические. Небольшая часть энергии тратится на реакцию фосфорилирования — при этом нет образования новой макроэргической связи. Большая часть рассеивается в виде тепла. Если мы захотим повернуть реакцию в другую сторону, то нам нужно затратить такое же количество энергии. В клеточных условиях такое сделать невозможно.
При гидролизе макроэргической связи выделяется большое количество энергии. Из-за этого первая и третья реакции гликолиза необратимы.
В десятой реакции из фосфоенолпирувата образуется пируват и молекула АТФ. Это реакция субстратного фосфорилирования. С двух сторон в этом уравнении есть макроэргические связи: слева в молекуле фосфоенолпирувата, а справа в молекуле АТФ. Кажется, что она должна быть обратимой. Но нет! От фосфоенолпирувата отщепляется фосфорная группа — образуется енольная форма пирувата. Енольная форма нестабильна, поэтому она быстро переходит в кетонную форму. Кетонная форма более стабильна, поэтому при клеточных условиях мы не можем повести реакцию в другую сторону. Так что эта реакция тоже необратима.
Десятая реакция глиоклиза необратима.
Выходит, что глюконеогенез не может быть обратным гликолизом. Это просто невозможно. В клеточных условиях нам не повернуть эти три реакции в другую сторону. Но, как говорится, умный в гору не пойдёт, умный гору обойдёт.
Клетке нужно обойти только три этих необратимых реакции. Ведь остальные семь — обратимые. Клетка воспользуется ими для синтеза глюкозы. Поэтому суть глюконеогенеза — обойти три необратимые реакции гликолиза. Клетка делает это через создание обходных путей. Но на это способны не все клетки, а только клетки определённых органов. Глюконеогенез идёт в печени, корковом веществе почек и слизистой тонкого кишечника. Только в клетках этих органов есть ферменты, которые проводят реакции по обходным путям. Наиболее активно глюконеогенез протекает в печени.
Всего обходных пути три, как и необратимых реакций гликолиза. Давайте посмотрим на гликолиз и глюконеогенез в сравнении:
Общая схема гликолиза и глюконеогенеза. Ферменты обходных путей синим цветом.
Мы начнём разбирать глюконеогенез с пирувата. Он будет нашим первым субстратом. Чуть ниже посмотрим на другие субстраты глюконеогенеза.
Гликолиз – ход реакции
 На первой стадии гликолиза (реакции 1–5) происходят превращения фосфорных эфиров сахаров, сопровождающиеся расходованием двух молекул АТФ на одну молекулу глюкозы. Образовавшийся фруктозо-1,6-дифосфат расщепляется на две молекулы 3-фосфоглицеринового альдегида, окислительно-восстановительное превращения которого происходят на следующей стадии гликолиза и сопровождаются образованием АТФ.
На первой стадии гликолиза (реакции 1–5) происходят превращения фосфорных эфиров сахаров, сопровождающиеся расходованием двух молекул АТФ на одну молекулу глюкозы. Образовавшийся фруктозо-1,6-дифосфат расщепляется на две молекулы 3-фосфоглицеринового альдегида, окислительно-восстановительное превращения которого происходят на следующей стадии гликолиза и сопровождаются образованием АТФ.
В процессе гликолитической оксидоредукции (реакции 6, 7) реализуется окисление 3-фосфоглицеринового альдегида до 3-фосфоглицериновой кислоты, сопряжённое с восстановлением НАД и фосфорилированием АДФ на уровне субстрата.
В процессе последующего превращения 3-фосфоглицериновой кислоты в пировиноградную кислоту через стадию образования фосфоенолпирувата (реакции 8–10) образуется ещё одна молекула АТФ.
При восстановлении пировиноградной кислоты за счёт восстановленного НАД возникает конечный продукт гликолиза — молочная кислота (реакция 11).
Таким образом, при распаде одной молекулы глюкозы по гликолитическому пути образуется:
- две молекулы молочной кислоты;
- две молекулы АТФ (с учётом АТФ, затраченной на первой стадии гликолиза).
Гликолиз энергетически менее выгоден, чем дыхание, так как поставляет около 5% энергии, которая может быть получена при полном окислении глюкозы до CO2 и H2O. Кроме глюкозы в гликолиз могут вовлекаться другие гексозы (манноза, галактоза, фруктоза), пентозы и глицерин.
Субстратом гликолиза у животных может также служить гликоген (в этом случае процесс называется гликогенолизом), а у растений — крахмал, глюкозные единицы которых вовлекаются в гликолиз благодаря действию гликоген фосфорилазы (реакция 12) или фосфорилазы крахмала и фосфоглюкомутазы (реакция 13).
В процессе гликогенолиза (наиболее интенсивно протекает в мышцах) при распаде одной глюкозной единицы запасается три молекулы АТФ.
Все реакции гликолиза, за исключением 1-й, 3-й и 10-й, обратимы; при образовании глюкозы из неуглеводных соединений реализуется обращение обратимых и «обход» необратимых реакций гликолиза.
Ключевой стадией, лимитирующей скорость гликолиза, является реакция, катализируемая аллостерическим ферментом фосфофруктокиназой, активность которого стимулируется АМФ и АДФ и подавляется АТФ и лимонной кислотой. Важную роль в регуляции играют также другие ферменты гликолиза. В присутствии кислорода скорость гликолиза снижается в связи с началом дыхания (эффект Пастера), это обеспечивает более эффективный механизм образования богатых энергией связей. В опухолевых клетках, безъядерных эритроцитах, эмбриональных и некоторых других тканях обнаружен активный гликолиз в присутствии O2 (т. н. аэробный гликолиз).
Реакции гликолиза, гликогенолиза и глюконеогенеза. Светлые стрелки — путь гликолиза, тёмные стрелки — путь глюконеогенеза. В рамках указаны субстраты гликолиза и глюконеогенеза. Реакции гликолиза катализируются ферментами: гексокиназой, или глюкокиназой (1), фосфоглюкоизомеразой (2), фосфофруктокиназой (3), альдолазой (4), триозофосфатизомеразой (5), глицеральдегид-3-фосфатдегидрогеназой (6), фосфоглицераткиназой (7), фосфоглицеромутазой (8), енолазой (9), пируваткиназой (10), лактатдегидрогеназой (11). Дополнительные реакции, обеспечивающие осуществление гликогенолиза, катализируются ферментами: фосфорилазой (12) и фосфоглюкомутазой (13). Реакции глюконеогенеза, идущие в «обход» необратимых (1,3, 10) реакций гликолиза, катализируются ферментами пируваткарбоксилазой (14), малатдегидрогеназой (15), фосфоенолпируваткарбоксикиназой (16), фруктозодифосфатазой (17), глюкозо-6-фосфатазой (18).
ЛокализацияПравить
В клетках эукариотических организмов десять ферментов, катализирующих распад глюкозы до ПВК, находятся в цитозоле, все остальные ферменты, имеющие отношение к энергетическому обмену, — в митохондриях. Поступление глюкозы в клетку осуществляется двумя путями: натрий-зависимый ко-транспорт (преимущественно для энтероцитов и эпителия почечных канальцев) и облегчённая диффузия глюкозы с помощью белков-переносчиков. Работа этих белков-транспортёров контролируется гормонами и, в первую очередь, инсулином. Сильнее всего инсулин стимулирует транспорт глюкозы в мышцах и жировой ткани.
Путь[править]
Первой реакцией гликолиза является фосфорилирование молекулы глюкозы, происходящее при участии тканеспецефичного фермента гексокиназы с затратой энергии 1 молекулы АТФ; образуется активная форма глюкозы — глюкозо-6-фосфат (Г-6-Ф):
Для протекания реакции необходимо наличие в среде ионов Mg2+, с которым комплексно связывается молекула АТФ. Эта реакция необратима и является первой ключевой реакцией гликолиза.
Фосфорилирование глюкозы преследует две цели: во-первых, из-за того что плазматическая мембрана, проницаемая для нейтральной молекулы глюкозы, не пропускает отрицательно заряженные молекулы Г-6-Ф, фосфорилированная глюкоза оказывается запертой внутри клетки. Во-вторых, при фосфорилировании глюкоза переводится в активную форму, способную участвовать в биохимических реакциях и включаться в метаболические циклы. Фосфорилирование глюкозы — это единственная реакция в организме, в которой глюкоза участвует как таковая.
Печёночный изофермент гексокиназы — глюкокиназа — имеет важное значение в регуляции уровня глюкозы в крови.
В следующей реакции (2) ферментом фосфоглюкоизомеразой Г-6-Ф превращается во фруктозо-6-фосфат (Ф-6-Ф):
Энергия для этой реакции не требуется, и реакция является полностью обратимой. На данном этапе в процесс гликолиза может также включаться путём фосфорилирования и фруктоза.
Далее почти сразу друг за другом следуют две реакции: необратимое фосфорилирование фруктозо-6-фосфата (3) и обратимое альдольное расщепление образовавшегося фруктозо-1,6-бифосфата (Ф-1,6-бФ) на две триозы (4).
Фосфорилирование Ф-6-Ф осуществляется фосфофруктокиназой с затратой энергии ещё одной молекулы АТФ; это вторая ключевая реакция гликолиза, её регуляция определяет интенсивность гликолиза в целом.
Альдольное расщепление Ф-1,6-бФ происходит под действием альдолазы фруктозо-1,6-бифосфата:
В результате четвёртой реакции образуются дигидроксиацетонфосфат и глицеральдегид-3-фосфат, причём первый почти сразу под действием фосфотриозоизомеразы переходит во второй (5), который и участвует в дальнейших превращениях:
Каждая молекула глицеральдегидфосфата окисляется НАД+ в присутствии дегидрогеназы глицеральдегидфосфата до 1,3-дифосфоглицерата (6):
Далее с 1,3-дифосфоглицерата, содержащего макроэргическую связь в 1 положении, ферментом фосфоглицераткиназой на молекулу АДФ переносится остаток фосфорной кислоты (реакция 7) — образуется молекула АТФ:
Это первая реакция субстратного фосфорилирования. С этого момента процесс расщепления глюкозы перестаёт быть убыточным в энергетическом плане, так как энергетические затраты первого этапа оказываются компенсированными: синтезируются 2 молекулы АТФ (по одной на каждый 1,3-дифосфоглицерат) вместо двух потраченных в реакциях 1 и 3. Для протекания данной реакции требуется присутствие в цитозоле АДФ, то есть при избытке в клетке АТФ (и недостатке АДФ) её скорость снижается. Поскольку АТФ, не подвергающийся метаболизму, в клетке не депонируется а просто разрушается, то эта реакция является важным регулятором гликолиза.
Затем последовательно: фосфоглицеролмутаза образует 2-фосфоглицерат (8):
Енолаза образует фосфоенолпируват (9):
И наконец происходит вторая реакция субстратного фосфорилирования АДФ с образованием енольной формы пирувата и АТФ (10):
Реакция протекает под действием пируваткиназы. Это последняя ключевая реакция гликолиза. Изомеризация енольной формы пирувата в пируват происходит неферментативно.
С момента образования Ф-1,6-бФ с выделением энергии протекают только реакции 7 и 10, в которых и происходит к субстратное фосфорилировнаие АДФ.
Значение гликолиза в физиологии живых организмов
Филогенетически гликолиз наиболее древний путь расщепления глюкозы, широко распространён в природе и играет важную роль в обмене веществ живых организмов. Обеспечивает клетку энергией в условиях недостаточного снабжения кислородом (у облигатных анаэробов гликолиз — единственный процесс, поставляющий энергию), а в аэробных условиях гликолиз является стадией, предшествующей дыханию — окислительному распаду углеводов до CO2 и H2O.
У высших животных, в том числе млекопитающих, гликолиз интенсивно происходит в скелетных мышцах, печени, сердце, эритроцитах, сперматозоидах, эмбриональных и других растущих (в т. ч. опухолевых) тканях. Ферменты гликолиза локализованы в растворимой части цитоплазмы клеток. Многим микроорганизмам свойствен идентичный гликолизу процесс гомоферментативного молочнокислого брожения. Большинство других типов сбраживания углеводов являются вариантами гликолиза.






