Аэробный и анаэробный гликолиз. какова их роль в жизнедеятельности человеческого организма?
Содержание:
- Что такое гликолиз
- Стадии процесса
- Значение гликолиза
- Этапы метаболизма
- История исследования
- Медицинская значимость
- Путь[править]
- Физиологическое значение
- Обходной путь 3. Образование глюкозы
- Примеры заданий
- Значение гликолиза в физиологии живых организмов
- Обходной путь 1. Образование фосфоенолпирувата
- Специфика процесса
- Гликолиз – ход реакции
- Гликолиз в раковых клетках
- Регуляция общего пути катаболизма
Что такое гликолиз
В общих чертах, гликолиз — это процесс, который происходит в цитоплазме всех клеток: от низших бактерий до высших млекопитающих — людей. Для некоторых это единственный метаболический путь доставки энергии клетке — например, для бактерий, для других же это метаболический путь, в который «сливаются» и другие метаболиты — белки и липиды.
Гликолиз — это основной путь расщепления глюкозы в нашем организме, основное биологическое значениеэтого процесса заключается в получении энергии и других продуктов обмена.
 Гликолиз происходит как в аэробных, так и в анаэробных условиях. Процесс в анаэробных условиях (недостаток кислорода) называется анаэробным гликолизом — конечным продуктом лактата и ферментации в дрожжах — алкогольной или молочнокислой ферментации.
Гликолиз происходит как в аэробных, так и в анаэробных условиях. Процесс в анаэробных условиях (недостаток кислорода) называется анаэробным гликолизом — конечным продуктом лактата и ферментации в дрожжах — алкогольной или молочнокислой ферментации.
При наличии кислорода этот процесс называется аэробным гликолизом — конечным продуктом выступают CO2 и H2O,
Гликолиз представляет собой серию реакций, в которых одна молекула глюкозы распадается на две молекулы пирувата. Но так происходит не всегда, в случаях когда доступ кислорода в этой реакции затруднен, проще говоря, в анаэробных условиях, то пируват превращается в лактат или спирт.
Механизмы анаэробного метаболизма: гликолиз в анаэробных условиях
В анаэробных условиях O2 отсутствует. Отсутствие конечного субстрата O2 ингибирует активность дыхательных структур (до этого они неактивны), и таким образом конечным продуктом распада глюкозы в анаэробных условиях является лактат,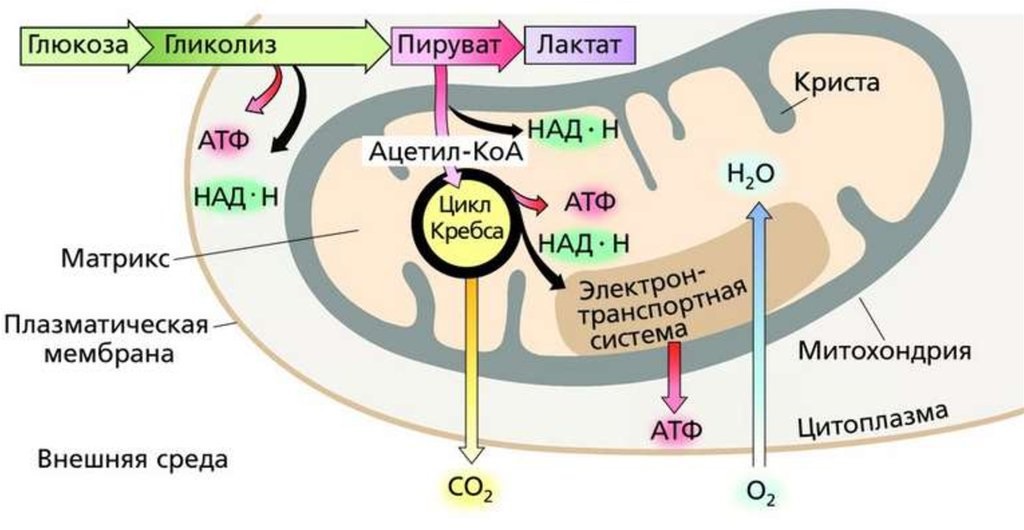
Анаэробный распад глюкозы в физиологических условиях наблюдается в эритроцитах (без митохондрий) и в сильно сокращающихся мышцах (недостаточное кровоснабжение кислородом), это наблюдается при сильной физической работе — присутствует истощение O2 в мышечных клетках (в форме оксимиоглобина).
Лактат в мышечных клетках приводит к мышечной лихорадке, которая преодолевается неинтенсивной мышечной активностью, направленной на полное расщепление лактата в мышцах, до CO2 , H2O и H2 в результате аэробного гликолиза.
При патологических состояниях и онкологических заболеваниях, у многих людей наблюдается так называемый эффект Пастера, при котором клетки из-за уменьшенного поступления крови или кислорода переключаются на анаэробный распад глюкозы, связанный с повышенным ее потреблением (повышенная экспрессия трансмиттеров глюкозы GLUT1 ) и гипогликемией.
Анаэробный гликолиз, как при физиологических, так и при патологических состояниях, характеризуется повышенным уровнем конечного продукта в результате расщепления его лактата в плазме крови — лактатемией, что может привести к ацидозу.
Дальнейшее расщепление лактата
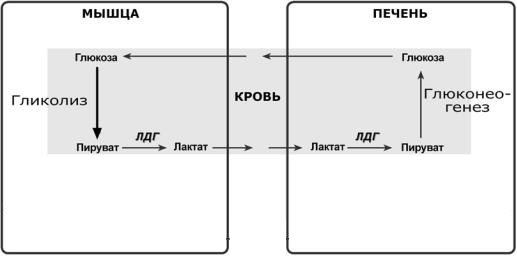
Лактат метаболизируется из печени в пируват, катализируя реакцию в обратном направлении, и глюкоза синтезируется пируватом с использованием ферментов глюконеогенеза в печени через цикл Кори (лактатный цикл).
Вот в этой схеме и кроется ответ на вопрос о том, как влияет анаэробный гликолиз на производство энергии, ведь мы видим, что наша молочная кислота, образовавшаяся в мышцах, через кровь попадает в печень и участвует в процессе глюконеогенеза — создания глюкозы из неуглеводных продуктов.
Стадии процесса
Процесс гликолиза происходит в клетках живых организмов. Он сопровождается образованием пировиноградной кислоты, состоит из нескольких этапов. Для дыхательного распада нужно активировать глюкозу. Происходит подобный процесс при фосфорилировании атома углерода при взаимодействии с АТФ.
глюкоза + АТФ = глюкозо-6-фосфат + АДФ
Для проведения данного химического взаимодействия используют катионы магния и гексокиназу (фермент). Далее происходит изомеризация продукта реакции в фруктозу-6-фосфат. В качестве катализатора применяют фермент фосфоглюкоизомеразу.
Гликолиз глюкозы характеризуется еще одной стадией, в которой участвует АТФ. Присоединение фосфорной кислоты происходит к первому атому углерода во фруктозе. Последующие этапы гликолиза связаны с расцеплением полученного фруктозо-1,6-дифосфата до триоз, образованием ФГА (3-фосфоглицеринового альдегида).
Гликолиз — многостадийный процесс, связанный с выделением энергии. При расщеплении одной молекулы глюкозы получают две молекулы ФГА, поэтому происходит их повтор.
Гликолиз — это процесс, который в суммарном виде представлен уравнением:
C6H12O6 + 2АТФ + 2НАД + 2Фн + 4АДФ → 2ПВК 2НАДН + 2Н+ + 4АТФ + 2АДФ
Значение гликолиза
Гликолиз — это уникальный, однако не единственный вид окисления глюкозы в организме, клетке как прокариотов, так и эукариотов. Ферменты гликолиза являются водорастворимыми. Реакция гликолиза в некоторых тканях и клетках может происходить только таким образом, например, в мозгу и клетках нефронов печени. Другие способы окисления глюкозы в этих органах не используются. Однако не везде функции гликолиза одинаковы. Например, жировые ткани и печени в процессе пищеварения добывают необходимые субстраты из глюкозы для синтеза жиров. Многие растения используют гликолиз как способ добычи основной части энергии.
Этапы метаболизма
Первый этап — подготовительный. Здесь сложные органические вещества (полимеры) распадаются до более простых (мономеров). Например, белки распадаются до аминокислот, а полисахариды до моносахаридов. Сами понимаете, что энергии при этом выделяется очень мало, она не запасается в молекулах АТФ, а выделяется в окружающую среду в виде тепла. Это знакомый нам процесс — пищеварение, он происходит в пищеварительной системе.
Что делать организмам, у которых пищеварительной системы нет? Они тоже осуществяют пищеварение, но другими способами. Например, у одноклеточных животных внутриклеточное пищеварение происходит в лизосомах и пищеварительных вакуолях.
Второй этап имеет сразу несколько названий. Например, бескислородный или анаэробный, так как он происходит без участия кислорода. Еще одно название — гликолиз («глико» — сахар, «лизис» — расщепление). Глюкоза расщепляется до двух молекул пировиноградной кислоты (ПВК), при этом энергия запасается в виде двух молекул АТФ. Легко запомнить: во время второго этапа выделяется две ПВК и две АТФ. Гликолиз проходит в цитоплазме клетки.
Дальнейшая судьба ПВК зависит от кислорода — если он есть, начинается третий этап, а если его не хватает, ПВК превращается в молочную кислоту. Например, в мышцах при высокой нагрузке и недостатке кислорода образуется молочная кислота. Человек испытывает неприятные ощущения, и даже боль. А в клетках растений и некоторых грибов (яркий пример — дрожжи) при недостатке кислорода ПВК распадается до этилового спирта и углекислого газа — происходит спиртовое брожение.
У аэробных организмов проходит еще и третий этап. Кислородный этап или аэробный, проходит в кислородной среде, другое название — клеточное дыхание. Он проходит только в эукариотических клетках, на кристах митохондрий. ПВК вступает в циклические реакции и полностью окисляется до углекислого газа и воды, а энергия запасается в 36 молекулах АТФ.
История исследования
Гликолиз первый из открытых и наиболее исследован метаболический путь. 1897 братья Ганс и Эдуард Бюхнер занимались изготовлением бесклеточной экстрактов дрожжей для терапевтического применения. Очевидно, они не могли использовать ядовитые для человека антисептики, как фенол, поэтому попытались распространен в кулинарии консервант — сахарозу. Выяснилось, что в дрожжевых экстрактах это вещество быстро зброджувалась к этиловому спирту. Так впервые установлено, что брожение может происходить вне живых клеток. В 1907 году Эдуарду Бюхнеру была присуждена Нобелевская премия по химии.
Со времени открытия внеклеточного брожения до 1940-х годов исследования реакций гликолиза было одной из основных задач биохимии. Описанием этого метаболического пути в клетках дрожжей занимались Отто Варбург, Ганс фон Эйлер-Хельпин и Артур Гарден (два последних получили Нобелевскую премию по химии 1929 года), в мышцах — Густав Эмбден и Отто Меергоф (Нобелевская премия по медицине и физиологии 1922 ). Также свой вклад в исследование гликолиза сделали Карл Нойберг, Яков Парнас, Герти и Карл Кори.
Важными «побочными» открытиями, сделанными благодаря изучению гликолиза, была разработка многих методов очистки ферментов, выяснения центральной роли АТФ и других фосфорильованих соединений в метаболизме, открытие коэнзимов, таких как НАД.
Медицинская значимость
По мере накопления лактата, который образуется при анаэробных условиях, развивается в крови лактацидоз. Он приводит к понижению реакции среды крови, что сопровождается резкими нарушениями в метаболизме клеток. Подобный процесс происходит при патологических процессах, связанных с нарушениями снабжения кислородом тканей. Например, при инфаркте миокарда, кровотечениях, легочной эмболии. Обусловлен этот процесс сахарным диабетом, при котором вместо аэробного гликолиза происходит анаэробный процесс.
Учитывая, что инсулин является ускорителем гликолиза, при первом типе диабета наблюдается замедление гликолиза. Именно поэтому те препараты, которые стимулируют ферменты, используемые для данного процесса, выполняют функцию лечения заболевания.
Путь[править]
Первой реакцией гликолиза является фосфорилирование молекулы глюкозы, происходящее при участии тканеспецефичного фермента гексокиназы с затратой энергии 1 молекулы АТФ; образуется активная форма глюкозы — глюкозо-6-фосфат (Г-6-Ф):
Для протекания реакции необходимо наличие в среде ионов Mg2+, с которым комплексно связывается молекула АТФ. Эта реакция необратима и является первой ключевой реакцией гликолиза.
Фосфорилирование глюкозы преследует две цели: во-первых, из-за того что плазматическая мембрана, проницаемая для нейтральной молекулы глюкозы, не пропускает отрицательно заряженные молекулы Г-6-Ф, фосфорилированная глюкоза оказывается запертой внутри клетки. Во-вторых, при фосфорилировании глюкоза переводится в активную форму, способную участвовать в биохимических реакциях и включаться в метаболические циклы. Фосфорилирование глюкозы — это единственная реакция в организме, в которой глюкоза участвует как таковая.
Печёночный изофермент гексокиназы — глюкокиназа — имеет важное значение в регуляции уровня глюкозы в крови.
В следующей реакции (2) ферментом фосфоглюкоизомеразой Г-6-Ф превращается во фруктозо-6-фосфат (Ф-6-Ф):
Энергия для этой реакции не требуется, и реакция является полностью обратимой. На данном этапе в процесс гликолиза может также включаться путём фосфорилирования и фруктоза.
Далее почти сразу друг за другом следуют две реакции: необратимое фосфорилирование фруктозо-6-фосфата (3) и обратимое альдольное расщепление образовавшегося фруктозо-1,6-бифосфата (Ф-1,6-бФ) на две триозы (4).
Фосфорилирование Ф-6-Ф осуществляется фосфофруктокиназой с затратой энергии ещё одной молекулы АТФ; это вторая ключевая реакция гликолиза, её регуляция определяет интенсивность гликолиза в целом.
Альдольное расщепление Ф-1,6-бФ происходит под действием альдолазы фруктозо-1,6-бифосфата:
В результате четвёртой реакции образуются дигидроксиацетонфосфат и глицеральдегид-3-фосфат, причём первый почти сразу под действием фосфотриозоизомеразы переходит во второй (5), который и участвует в дальнейших превращениях:
Каждая молекула глицеральдегидфосфата окисляется НАД+ в присутствии дегидрогеназы глицеральдегидфосфата до 1,3-дифосфоглицерата (6):
Далее с 1,3-дифосфоглицерата, содержащего макроэргическую связь в 1 положении, ферментом фосфоглицераткиназой на молекулу АДФ переносится остаток фосфорной кислоты (реакция 7) — образуется молекула АТФ:
Это первая реакция субстратного фосфорилирования. С этого момента процесс расщепления глюкозы перестаёт быть убыточным в энергетическом плане, так как энергетические затраты первого этапа оказываются компенсированными: синтезируются 2 молекулы АТФ (по одной на каждый 1,3-дифосфоглицерат) вместо двух потраченных в реакциях 1 и 3. Для протекания данной реакции требуется присутствие в цитозоле АДФ, то есть при избытке в клетке АТФ (и недостатке АДФ) её скорость снижается. Поскольку АТФ, не подвергающийся метаболизму, в клетке не депонируется а просто разрушается, то эта реакция является важным регулятором гликолиза.
Затем последовательно: фосфоглицеролмутаза образует 2-фосфоглицерат (8):
Енолаза образует фосфоенолпируват (9):
И наконец происходит вторая реакция субстратного фосфорилирования АДФ с образованием енольной формы пирувата и АТФ (10):
Реакция протекает под действием пируваткиназы. Это последняя ключевая реакция гликолиза. Изомеризация енольной формы пирувата в пируват происходит неферментативно.
С момента образования Ф-1,6-бФ с выделением энергии протекают только реакции 7 и 10, в которых и происходит к субстратное фосфорилировнаие АДФ.
Физиологическое значение
Гликолиз можно считать универсальным способом катаболизма глюкозы. Его активно используют про- и эукариотические организмы. Ферменты, являющиеся катализаторами гликолиза, растворяются в воде, накапливаются в цитозоле. Часть клеток и тканей животных могут катаболизировать гексозу только путем гликолиза. Например, подобные способности есть у клеток почечных каналов, нейронов мозга.
В жировой ткани и печени есть некоторые отличия в физиологической роли гликолиза. При пищеварении в жировой ткани и в печени данный процесс является источником субстратов, используемых в синтезе жиров.
Часть тканей растений запасают крахмал в клубнях. Водные растения энергию получают через гликолиз.
В анаэробных условиях происходит превращение пирувата в этанол и лактат. Процесс сопровождается выделением большого количества энергии.
Гликолиз имеет существенное физиологическое значение в адипоцитах. С его помощью вместо окислительного процесса происходит липогенез, позволяющий снижать окислительный стресс.
Обходной путь 3. Образование глюкозы
От глюкозо-6-фосфата отщепляется фосфатная группа. Катализирует реакцию глюкозо-6-фосфатаза.
Образование глюкозы в третьем обходном пути
Но этот фермент не может находиться в цитоплазме. Почему? Тогда клетка не смогла бы выполнять свои функции. Представьте, что глюкоза попадает в печень. Она сразу же фосфорилируется с помощью глюкокиназы. Так клетка добивается двух вещей:
- Увеличивает реакционную способность глюкозы;
- Не даёт глюкозе выбраться из клетки. Потому что для глюкозо-6-фосфата нет белков переносчиков в цитоплазме. А вот для обычной глюкозы есть —
Если мы засунем в эту систему фермент глюкозо-6-фосфатазу, то она будет постоянно превращать глюкозо-6-фосфат в глюкозу. А та будет вылетать из клетки. Получается, что вся система работает в холостую. Поэтому глюкозо-6-фосфатаза не работает в цитоплазме, а находится в эндоплазматическом ретикулуме (ЭПР). Он отделён от цитоплазмы биологической мембраной.
В мембране ЭПР есть белки переносчики для глюкозо-6-фосфата. Он переносится в ЭПР, где дефосфорилируется глюкозо-6-фосфатазой. Образуется глюкоза и неорганический фосфат. Они переносятся в цитоплазму, опять же с помощью своих белков переносчиков. А дальше глюкоза попадает в кровь через глюкозный транспортёр второго типа.
Глюкозо-6-фосфатаза работает в эндоплазматическом ретикулуме. Так клетка избегает холостых реакций.
Вот и весь глюконеогенез. Держите общую картинку.
Пируваткарбоксилаза не влезла, извиняйте.
Примеры заданий
Давайте разберем несколько заданий на энергетический обмен из ЕГЭ по биологии, чтобы закрепить знания на практике.
Пример 1. Что характерно для аэробного этапа энергетического процесса?
- протекает в лизосомах
- расщепляются молекулы ПВК
- наблюдается высокий выход молекул АТФ
- проходит в цитоплазме
- встречается у бактерий
- имеются циклические реакции
Решение. Аэробный или кислородный этап — третий этап энергетического обмена. Он проходит на кристах митохондрий, там расположены ферментативные комплексы и идут циклические реакции, в которых молекулы пировиноградной кислоты разрушаются, на этом этапе наблюдается высокий выход энергии —36 АТФ. В лизосомах проходит подготовительный этап, а в цитоплазме — гликолиз. Кислородный этап не характерен для бактерий, так как у них нет мембранных органоидов.
Ответ: 236
Пример 2. Установите соответствие между характеристикой энергетического обмена и его этапом
| ХАРАКТЕРИСТИКА | ЭТАП ЭНЕРГЕТИЧЕСКОГО ОБМЕНА | |
| A) происходит в аэробных условияхБ) происходит в цитоплазмеB) образуется молочная кислотаГ) образуется пировиноградная кислотаД) синтезируется 36 молекул АТФ | 1) гликолиз2) кислородное окисление |
Решение. Гликолиз — второй этап энергетического обмена, анаэробный, проходит в цитоплазме, образуется пировиноградная кислота, а при недостатке кислорода еще и молочная кислота. Кислородный — третий этап, аэробный, завершается образованием 36 молекул АТФ.
Ответ: 21112
Пример 3. В процессе гликолиза образовались 64 молекулы пировиноградной кислоты (ПВК). Какое количество молекул глюкозы подверглось расщеплению и сколько молекул АТФ образуется при полном окислении глюкозы в клетках эукариот? Ответ поясните
Решение:
- Во время гликолиза одна молекула глюкозы распадается до двух молекул пировиноградной кислоты. Для образования 64 молекул ПВК расщепилось 32 молекулы глюкозы (64:2).
- При полном окислении одной молекулы глюкозы в эукариотической клетке образуется 38 молекул АТФ. При расщеплении 32 молекул глюкозы образуется 1216 молекул АТФ (38*32).
Как видите, энергетический обмен — важная часть ЕГЭ по биологии. Справиться с заданиями достаточно просто, если знать, что происходит на каждом из этапов.
Значение гликолиза в физиологии живых организмов
Филогенетически гликолиз наиболее древний путь расщепления глюкозы, широко распространён в природе и играет важную роль в обмене веществ живых организмов. Обеспечивает клетку энергией в условиях недостаточного снабжения кислородом (у облигатных анаэробов гликолиз — единственный процесс, поставляющий энергию), а в аэробных условиях гликолиз является стадией, предшествующей дыханию — окислительному распаду углеводов до CO2 и H2O.
У высших животных, в том числе млекопитающих, гликолиз интенсивно происходит в скелетных мышцах, печени, сердце, эритроцитах, сперматозоидах, эмбриональных и других растущих (в т. ч. опухолевых) тканях. Ферменты гликолиза локализованы в растворимой части цитоплазмы клеток. Многим микроорганизмам свойствен идентичный гликолизу процесс гомоферментативного молочнокислого брожения. Большинство других типов сбраживания углеводов являются вариантами гликолиза.
Обходной путь 1. Образование фосфоенолпирувата
Пируват, который образовался в ходе гликолиза был транспортирован в митохондрию. Нам повезло, потому что первый фермент обходного пути тоже находится в матриксе митохондрии. Этот фермент — митохондриальная пируваткарбокилаза.
Пируваткарбоксилаза присоединяет к пирувату CO2 — образуется оксалоацетат.
Первая реакция в образовании фосфоенолпирувата. Идёт в матриксе митохондрий.
Для этой реакции нужны молекула АТФ и кофермент — биотин. АТФ тратится на активацию бикарбонатного иона, так как у нас в организме большая часть CO2 растворена. Из бикарбонатного иона образуется CO2, который присоединяется к биотину. Биотин переносит CO2 на молекулу пирувата, клетка получает оксалоацетат.
Дальше нужно перенести оксалоацетат в цитоплазму клетки — там находятся семь ферментов, которые катализируют обратимые реакции гликолиза. Для оксалоацетата во внутренней мембране митохондрий нет переносчика. Но есть для малата. Поэтому сначала оксалоацетат превращается в малат. Катализатор — митохондриальная малатдегидрогеназа. Она присоединяет два протона и два электрона к молекуле оксалоацетата. Кофермент реакции — НАДH. Так образуется малат.
Образование малата в митохондрии
Митохондриальная малатдегидрогеназа обычно катализирует обратную реакцию — превращение малата в оксалоацетат. Так было в но почему здесь всё по-другому? Дело в том, что в митохондрии находится избыток НАДH, а не НАД+. Поэтому реакция идёт в другую сторону. Избыток НАДH обеспечивает окисление жирных кислот — запускается при голодании и/или физической нагрузке.
Далее малат транспортируется через внутреннюю мембрану с помощью белка-переносчика. В наружной мембране есть поры, поэтому дальше он влетает в цитоплазму.
Транспорт малата в цитоплазму
В цитоплазме клетки малат превращается в оксалоацетат с помощью цитоплазматической малатдегидрогеназы. При этом образуется оксалоацетат и НАДH. Эта реакция полезна, так как в шестой реакции для образования глицеральдегид-3-фосфата нужен НАДH. Так митохондрия передаёт избыток протонов и электронов на нужды цитоплазмы — всё это через образование малата.
Образование оксалоацетата в цитоплазме клетки
Теперь нужно превратить оксалоацетат в фосфоенолпируват. Для этого нужен второй фермент этого обходного пути — фосфоенолпируваткарбоксикиназа. Он получил название по обратной реакции. Кроме фермента, нужен источник энергии и фосфатной группы — здесь используется ГТФ. Образуется фосфоенолпируват, ГДФ и CO2. Так клетка обходит десятую реакцию гликолиза.
Вторая реакция обходного пути. Образование фосфоенолпирувата с помощью декарбоксилирования оксалоацетата
Пока что глюконеогенез дорогой процесс. Мы затратили молекулу АТФ и ГТФ на образование фосфоенолпирувата. А эта молекула содержит только три атома углерода. Для образования глюкозы нужно образовать два фосфоенолпирувата. То есть общие затраты энергии — 2 молекулы АТФ и 2 ГТФ.
Дальше идут обратимые реакции до образования фруктозо-1,6-бисфосфата (третья реакция гликолиза). В ходе седьмой реакции мы затратим ещё две молекулы АТФ на образование двух 1,3-бисфосфоглицератов.
Общие затраты энергии — 4 молекулы АТФ и 2 молекулы ГТФ. Дальше клетка не будет тратиться на синтез глюкозы, так что это общие затраты на весь глюконеогенез.
Хоть этот процесс и дорогой, но других вариантов у организма нет. Нельзя же бросить мозг и эритроциты — без них тело долго не проживёт.
Специфика процесса
Многочисленные исследования химической сути данного процесса продемонстрировали, что у начальных этапов брожения и дыхания есть сходство. Благодаря этому открытию ученые объяснили единство в живом мире. Анаэробный гликолиз происходит после того, как прошел цикл трикарбоновых кислот, завершился перенос свободных электронов. В митохондрии попадает пируват, происходит его окисление до углекислого газа. Это приводит к выделению свободной энергии из гексозы. Ферменты, являющиеся ускорителями гликолитических реакций, во многих клетках находятся в растворимой форме в цитозоле. Ускорители процесса окисления гексоз, происходящего в присутствии кислорода, сконцентрированы в митохондриальных мембранах.
Для расщепления молекулы углевода, включающего шесть атомов углерода на две молекулы, необходимо присутствие десяти активных ферментов. Исследователям удалось выделить их в чистом виде, изучить их физические и химические характеристики.
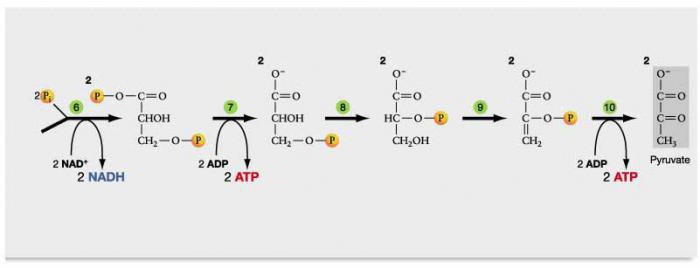
Гликолиз – ход реакции
 На первой стадии гликолиза (реакции 1–5) происходят превращения фосфорных эфиров сахаров, сопровождающиеся расходованием двух молекул АТФ на одну молекулу глюкозы. Образовавшийся фруктозо-1,6-дифосфат расщепляется на две молекулы 3-фосфоглицеринового альдегида, окислительно-восстановительное превращения которого происходят на следующей стадии гликолиза и сопровождаются образованием АТФ.
На первой стадии гликолиза (реакции 1–5) происходят превращения фосфорных эфиров сахаров, сопровождающиеся расходованием двух молекул АТФ на одну молекулу глюкозы. Образовавшийся фруктозо-1,6-дифосфат расщепляется на две молекулы 3-фосфоглицеринового альдегида, окислительно-восстановительное превращения которого происходят на следующей стадии гликолиза и сопровождаются образованием АТФ.
В процессе гликолитической оксидоредукции (реакции 6, 7) реализуется окисление 3-фосфоглицеринового альдегида до 3-фосфоглицериновой кислоты, сопряжённое с восстановлением НАД и фосфорилированием АДФ на уровне субстрата.
В процессе последующего превращения 3-фосфоглицериновой кислоты в пировиноградную кислоту через стадию образования фосфоенолпирувата (реакции 8–10) образуется ещё одна молекула АТФ.
При восстановлении пировиноградной кислоты за счёт восстановленного НАД возникает конечный продукт гликолиза — молочная кислота (реакция 11).
Таким образом, при распаде одной молекулы глюкозы по гликолитическому пути образуется:
- две молекулы молочной кислоты;
- две молекулы АТФ (с учётом АТФ, затраченной на первой стадии гликолиза).
Гликолиз энергетически менее выгоден, чем дыхание, так как поставляет около 5% энергии, которая может быть получена при полном окислении глюкозы до CO2 и H2O. Кроме глюкозы в гликолиз могут вовлекаться другие гексозы (манноза, галактоза, фруктоза), пентозы и глицерин.
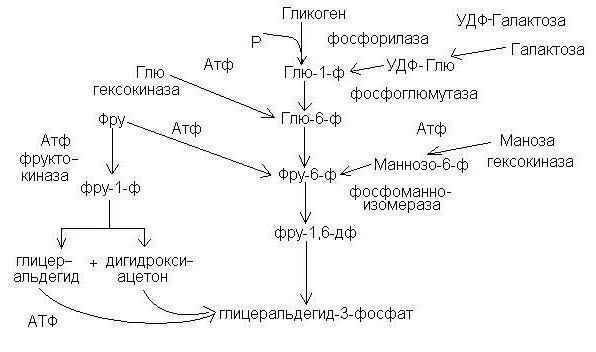
Субстратом гликолиза у животных может также служить гликоген (в этом случае процесс называется гликогенолизом), а у растений — крахмал, глюкозные единицы которых вовлекаются в гликолиз благодаря действию гликоген фосфорилазы (реакция 12) или фосфорилазы крахмала и фосфоглюкомутазы (реакция 13).
В процессе гликогенолиза (наиболее интенсивно протекает в мышцах) при распаде одной глюкозной единицы запасается три молекулы АТФ.
Все реакции гликолиза, за исключением 1-й, 3-й и 10-й, обратимы; при образовании глюкозы из неуглеводных соединений реализуется обращение обратимых и «обход» необратимых реакций гликолиза.
Ключевой стадией, лимитирующей скорость гликолиза, является реакция, катализируемая аллостерическим ферментом фосфофруктокиназой, активность которого стимулируется АМФ и АДФ и подавляется АТФ и лимонной кислотой. Важную роль в регуляции играют также другие ферменты гликолиза. В присутствии кислорода скорость гликолиза снижается в связи с началом дыхания (эффект Пастера), это обеспечивает более эффективный механизм образования богатых энергией связей. В опухолевых клетках, безъядерных эритроцитах, эмбриональных и некоторых других тканях обнаружен активный гликолиз в присутствии O2 (т. н. аэробный гликолиз).
Реакции гликолиза, гликогенолиза и глюконеогенеза. Светлые стрелки — путь гликолиза, тёмные стрелки — путь глюконеогенеза. В рамках указаны субстраты гликолиза и глюконеогенеза. Реакции гликолиза катализируются ферментами: гексокиназой, или глюкокиназой (1), фосфоглюкоизомеразой (2), фосфофруктокиназой (3), альдолазой (4), триозофосфатизомеразой (5), глицеральдегид-3-фосфатдегидрогеназой (6), фосфоглицераткиназой (7), фосфоглицеромутазой (8), енолазой (9), пируваткиназой (10), лактатдегидрогеназой (11). Дополнительные реакции, обеспечивающие осуществление гликогенолиза, катализируются ферментами: фосфорилазой (12) и фосфоглюкомутазой (13). Реакции глюконеогенеза, идущие в «обход» необратимых (1,3, 10) реакций гликолиза, катализируются ферментами пируваткарбоксилазой (14), малатдегидрогеназой (15), фосфоенолпируваткарбоксикиназой (16), фруктозодифосфатазой (17), глюкозо-6-фосфатазой (18).
Гликолиз в раковых клетках
1928 Отто Варбург обнаружил, что в раковых клетках почти всех типов гликолиз и поглощение глюкозы происходит примерно в 10 раз интенсивнее, чем у здоровых, даже в присутствии больших концентраций кислорода. Эффект Варбурга стал основой для разработки нескольких методов выявления и лечения рака.
Все раковые клетки, по крайней мере на начальных этапах развития опухоли растут в условиях гипоксии, то есть недостатка кислорода, из-за отсутствия сетки капилляров. Если они расположены на расстоянии более 100-200 мкм от ближайшей кровеносного сосуда, то должны полагаться только на гликолиз без дальнейшего окисления пирувата для получения АТФ. Йомвирно, что почти во всех раковых клетках в процессе злокачественной трансформации происходят следующие изменения: переход на получение энергии только путем гликолиза и приспособления к условиям повышенной кислотности, возникающих вследствие выделения молочной кислоты в межклеточную жидкость. Чем более агрессивная опухоль, тем быстрее в ней происходит гликолиз.
Приспособление раковых клеток к недостатку кислорода во многом происходит благодаря транскрипционных факторов индуцированном гипоксией (англ. Hypoxia-inducible transcription factor, HIF-1), который стимулирует повышение экспрессии как минимум восьми генов гликолитических ферментов, а также транспортеров глюкозы GLUT1 и GLUT3, активность которых не зависит от инсулина. Еще одним ефекторм HIF-1 является выделение клетками васкулярного эндотелиального фактора роста (англ. Vascular endothelial growth factor), что стимулирует образование кровеносных сосудов в опухоли. HIF-1 также выделяется мышцами во время тренировок, предусматривающие большую интенсивность нагрузки, в этом случае он имеет аналогичный эффект: усиливает способность к анаэробного синтеза АТФ и стимулирует рост капилляров.
В некоторых случаях повышенная интенсивность гликолиза может быть использована для нахождения местоположения опухоли в организме с помощью позитрон-эмиссионной томографии (ПЭТ). Пациенту в кровь вводят аналог глюкозы 2-флюоро-2-дезоксиглюкозу (ФДГ), меченый изотопом 18 F. Это вещество поглощается клетками и является субстратом для первого фермента гликолиза — гексокиназы, однако не может быть преобразована фосфоглюкоизмеразою, поэтому накапливается в цитоплазме. Скорость накопления зависит от интенсивности захвата аналога глюкозы и его фосфорилирования, оба процесса значительно быстрее происходят в раковых клетках, чем в здоровых. При распаде 18 F выделяются позитроны, которые фиксируются специальными сенсорами.
Особенности катаболизма глюкозы в злокачественных опухолях используются не только для диагностики, но и для разработки новых противораковых препаратов, среди которых: ингибиторы гексокиназы (2-дезоксиглюкоза, лонидамин, 3-бромпируват), Иматиниб (Gleevec), подавляющее определенную тирозинкиназы, которая стимулирует синтез гексокиназы, и другие.
Регуляция общего пути катаболизма
Осталось поговорить про регуляцию работы пируватдегидрогеназного комплекса и ЦТК. Основная задача для регуляции — поддерживать энергетическое соотношение в клетке. Если в клетке достаточно АТФ, то общий путь катаболизма должен быть отключён. Если концентрация АТФ падает, а нарастает АДФ или АМФ, то нужно запускать общий путь катаболизма.
Основной механизм регуляции пируватдегидрогеназного комплекса и ЦТК — . Она достаточно быстро и чутко реагирует на изменения энергетического соотношения в клетке. Удивительно, что гормональной регуляции с помощью фосфорилирования/дефосфорилирования здесь нет.
Организм отдал регуляцию общего пути катаболизма на усмотрение клетки. Гликолиз и такого доверия не заслужили. С другой стороны, зачем регулировать каждый этап катаболизма гормонально? Достаточно установить контроль над специфическими путями катаболизма, но я отвлёкся.
Регуляция окислительного декарбоксилирования пирувата
Пируватдегидрогеназный комплекс состоит не только из трёх ферментов и пяти коферментов. С первым ферментом (пируватдегидрогеназой) связаны ещё две белковые субъединицы: киназа и фосфатаза. Киназа фосфорилирует пируватдегидрогеназу по -OH группе — переводит её в неактивную форму. Такое случается при избытке АТФ внутри митохондрии. Отдыхаем после тяжёлого дня, лёжа на диване. Фосфатаза же увеличивает свою работоспособность при снижении концентрации АТФ внутри клетки. Это приводит к дефосфорилированию пируватдегидрогеназы — активация фермента. Бежим за маршруткой — нужна энергия.
Киназа и фосфатаза пируватдегидрогеназного комплекса
Это фофорилирование/дефосфорилирование, но не гормональное. Оно подкрепляет аллостерическую регуляцию. Киназа запускается при избытке АТФ, а фосфатаза при его дефиците. Но давайте перейдём к аллостерической регуляции.
Пируватдегидрогеназный комплекс аллостерически ингибируется: АТФ, НАДH, жирными кислотами, ацетил-коэнзимом А.
ПДК ингибируется: АТФ, НАДH, жирными кислотами и ацетил-коэнзимом А
Все эти продукты накапливаются, когда клетке не нужна энергия. Понятно дело, что нужно остановить общий путь катаболизма, если в клетке куча АТФ и субстратов для её синтеза.
Пируватдегидрогеназный комплекс аллостерически активируется: АДФ, НАД+, коэнзимом А, кальцием.
ПДК активируется: АДФ, НАД+, коэнзимом А и кальцием
С первыми тремя всё ясно — они накапливаются, когда клетке нужна энергия, а её не хватает. Нужно ускорить работу пируватдегидрогеназного комплекса — образовать больше ацетил-коэнзима А. Чем больше ацетил-коэнзима А, тем больше энергии будет получено в ходе ЦТК. А что с кальцием? Кальций работает в мышцах и сердце. При сокращениях небольшая часть кальция попадает в митохондрию. Это стимулирует активность пируватдегидрогеназного комплекса и других ферментов ЦТК — об этом ниже.
Регуляция цикла Кребса
Идёт по трём необратимым реакциям: первой, третьей и четвёртой. Регулируются два фермента и один комплекс: цитратсинтаза, изоцитратдегидрогеназа и альфа-кетоглутаратдегидрогеназный комплекс.
Цитратсинтаза. Аллостерически ингибируется: АТФ, НАДH, цитратом и сукцинил-коэнзимом А. Активируется: АДФ.
Изоцитратдегидрогеназа. Ингибируется: АТФ. Активируется: АДФ и кальцием.
Альфа-кетоглутаратдегидрогеназный комплекс. Ингибируется: НАДH и сукцинил-коэнзим А. Активируется: кальцием.
Регуляция ЦТК по первой, третьей и четвертой реакции.
Видно, что наибольшее количество аллостерических регуляторов у цитратсинтазы и пируватдегидрогеназного комплекса. Это неудивительно, две эти реакции отвечают за старт цикла. Цитратсинтаза ингибируется не только продуктом своей реакции, но и продуктом четвертой реакции — сукцинил-коэнзимом А.
Хочешь задать вопрос, похвалить или наговорить гадостей? Тогда залетай в телегу. Там ты сможешь предложить новый формат или разбор темы. А если серьёзно, то эти статьи пишутся для вас, поэтому мне важна обратная связь.






